Janumet diabēta ārstēšanai
Zīmols: Janumet
Vispārīgais nosaukums: sitagliptīns un metformīna hidrohlorīds
Saturs:
Indikācijas un lietošana
Devas un ievadīšana
Devas formas un stiprās puses
Kontrindikācijas
Brīdinājumi un piesardzība
Nevēlamās reakcijas
Mijiedarbība ar zālēm
Lietošana īpašās populācijās
Pārdozēšana
Apraksts
Farmakoloģija
Neklīniskā toksikoloģija
Klīniskie pētījumi
Kā piegādāts
Informācija par pacientu konsultācijām
Janumet, Sitagliptīns un metformīna hidrohlorīds, informācija par pacientu (vienkāršā angļu valodā)
BRĪDINĀJUMS: LAKTISKĀ ACIDOZE
Pienskābes acidoze ir reta, bet nopietna komplikācija, kas var rasties metformīna uzkrāšanās dēļ. Risks palielinās ar tādiem stāvokļiem kā sepsi, dehidratācija, alkohola pārmērīga lietošana, aknu mazspēja, nieru darbības traucējumi un akūta sastrēguma sirds mazspēja.
Sākums bieži ir smalks, un to papildina tikai nespecifiski simptomi, piemēram, savārgums, mialģijas, elpošanas traucējumi, pieaugoša miegainība un nespecifisks vēdera ciešanas. Laboratorijas anomālijas ietver zemu pH līmeni, palielinātu anjonu spraugu un paaugstinātu laktāta līmeni asinīs.
Ja ir aizdomas par acidozi, Janumet1 ir jāpārtrauc un pacients nekavējoties jā hospitalizē. [Skatīt Brīdinājumi un piesardzība]
Indikācijas un lietošana
Janumet ir indicēts kā papildinājums uzturam un fiziskiem vingrinājumiem, lai uzlabotu glikēmijas kontroli pieaugušajiem ar 2. tipa cukura diabētu, ja ir piemērota gan sitagliptīna, gan metformīna terapija. [Skatīt Klīniskie pētījumi.]
Svarīgi lietošanas ierobežojumi
Janumet nedrīkst lietot pacienti ar 1. tipa cukura diabētu vai diabētiskās ketoacidozes ārstēšanai, jo tas šajā gadījumā nebūtu efektīvs.
Janumet nav pētīts kombinācijā ar insulīnu.
tops
Devas un ievadīšana
Ieteicamā dozēšana
Janumet antihiperglikēmiskās terapijas deva jāindivizē individuāli, ņemot vērā pacienta pašreizējo režīmu, efektivitāte un panesamība, nepārsniedzot maksimālo ieteicamo dienas devu - 100 mg sitagliptīna un 2000 mg metformīns. Sākotnējā kombinētā terapija vai kombinētās terapijas uzturēšana būtu jā individualizē un jāatstāj veselības aprūpes sniedzēja ziņā.
Janumet parasti jāievada divas reizes dienā ēdienreizēs, pakāpeniski palielinot devu, lai samazinātu metformīna izraisītās kuņģa-zarnu trakta (GI) blakusparādības.
Janumet sākuma deva jābalsta uz pašreizējo pacienta shēmu. Janumet jālieto divas reizes dienā ēšanas laikā. Ir pieejamas šādas devas:
50 mg sitagliptīna / 500 mg metformīna hidrohlorīda
50 mg sitagliptīna / 1000 mg metformīna hidrohlorīda.
Pacienti, kuru kontrole nav pietiekama tikai ar diētu un fiziskām aktivitātēm
Ja pacientam ar 2. tipa cukura diabētu tiek uzskatīta par piemērotu terapiju ar kombinētām tabletēm, kas satur sitagliptīnu un metformīnu nepietiekami kontrolēts ar uzturu un fiziskām aktivitātēm, ieteicamā sākumdeva ir 50 mg sitagliptīna / 500 mg metformīna hidrohlorīda divreiz katru dienu. Pacientus ar nepietiekamu glikēmijas kontroli šajā devā var titrēt līdz 50 mg sitagliptīna / 1000 mg metformīna hidrohlorīda divas reizes dienā.
Pacienti, kuriem nepietiekami kontrolēja metformīna monoterapiju
Ja tiek uzskatīts par piemērotu terapiju ar kombinētām tabletēm, kas satur sitagliptīnu un metformīnu, ja pacientam nepietiekami kontrolē tikai metformīnu, ar ieteicamo Janumet sākumdevu būtu jāsniedz sitagliptīns pa 50 mg divas reizes dienā (100 mg kopējā dienas deva), un metformīna deva jau ir ņemts. Pacientiem, kuri lieto metformīnu 850 mg divreiz dienā, Janumet ieteicamā sākumdeva ir 50 mg sitagliptīna / 1000 mg metformīna hidrohlorīda divreiz dienā.
Pacienti, kuriem nepietiekami kontrolēja sitagliptīna monoterapiju
Ja terapija ar kombinētām tabletēm, kas satur sitagliptīnu un metformīnu, tiek uzskatīta par piemērotu pacientam nepietiekami kontrolējot tikai ar sitagliptīnu, ieteicamā Janumet sākuma deva ir 50 mg sitagliptīna / 500 mg metformīna hidrohlorīda divreiz katru dienu. Pacientus ar nepietiekamu šīs devas kontroli var titrēt līdz 50 mg sitagliptīna / 1000 mg metformīna hidrohlorīda divreiz dienā. Pacientiem, kuri lieto sitagliptīna monoterapijas devu, kas pielāgota nieru mazspējai, nevajadzētu pāriet uz Janumet. Kontrindikācijas].
Pacienti, pārejot no sitagliptīna un metformīna vienlaikus lietošanas
Pacientiem, kuri sāk lietot sitagliptīnu vienlaikus ar metformīnu, Janumet var sākt lietot sitagliptīna un metformīna devās.
Pacienti, kuri nav pietiekami kontrolēti divkāršā kombinētajā terapijā ar jebkuru no šiem antihiperglikēmiskajiem līdzekļiem: sitagliptīnu, metformīnu vai sulfonilurīnvielu
Ja šajā gadījumā terapija ar kombinētām tabletēm, kas satur sitagliptīnu un metformīnu, tiek uzskatīta par piemērotu iestatot, parastā Janumet sākuma deva nodrošina sitagliptīna devu pa 50 mg divas reizes dienā (kopā 100 mg) dienas deva). Nosakot metformīna komponenta sākumdevu, jāņem vērā pacienta glikēmiskās kontroles līmenis un metformīna pašreizējā deva (ja tāda ir). Jāapsver pakāpeniska devas palielināšana, lai samazinātu ar metformīnu saistītās blakusparādības kuņģa-zarnu traktā (GI). Pacientiem, kuri pašlaik lieto vai sāk lietot sulfonilurīnvielu, var būt nepieciešamas mazākas sulfonilurīnvielas devas, lai samazinātu hipoglikēmijas risku [skatīt Brīdinājumi un piesardzība].
Nav veikti īpaši pētījumi, lai pārbaudītu Janumet nekaitīgumu un efektivitāti pacientiem, kuri iepriekš tika ārstēti ar citiem perorāliem antihiperglikēmiskiem līdzekļiem un pārgāja uz Janumet. Visas 2. tipa diabēta terapijas izmaiņas jāveic uzmanīgi un atbilstoši jāuzrauga, jo var mainīties glikēmijas kontrole.
tops
Devas formas un stiprās puses
- 50 mg / 500 mg tabletes ir gaiši rozā, kapsulas formas, apvalkotas tabletes ar iespiestu "575" vienā pusē.
- 50 mg / 1000 mg tabletes ir sarkanas, kapsulas formas, apvalkotas tabletes ar iespiestu "577" vienā pusē.
tops
Kontrindikācijas
Janumet (sitagliptīns / metformīna HCl) ir kontrindicēts pacientiem ar:
- Nieru slimība vai nieru disfunkcija, piemēram, kā ierosina seruma kreatinīna līmenis â ‰ ¥ 1,5 mg / dL [vīrieši], ‰ ‰ mg 1,4 mg / dL [sievietes] vai patoloģiska kreatinīna klīrenss, ko var izraisīt arī tādi apstākļi kā sirds un asinsvadu sabrukums (šoks), akūts miokarda infarkts un septicēmija [skat Brīdinājumi un piesardzība].
- Akūta vai hroniska metaboliskā acidoze, ieskaitot diabētisko ketoacidozi, ar komu vai bez tās.
- Nopietnas paaugstinātas jutības reakcijas pret Janumet vai sitagliptīnu (viens no Janumet komponentiem) anamnēzē, piemēram, anafilakse vai angioneirotiskā tūska. [Skatīt Brīdinājumi un piesardzība un Nevēlamās reakcijas.]
Janumet lietošana uz laiku jāpārtrauc pacientiem, kuriem veic radioloģiskus pētījumus, kuros iesaistīti intravaskulāri jodu saturošu kontrastvielu ievadīšana, jo šādu produktu lietošana var izraisīt akūtas nieru izmaiņas funkcija [sk Brīdinājumi un piesardzība].
tops
Brīdinājumi un piesardzība
Pienskābes acidoze
Metformīna hidrohlorīds
Pienskābes acidoze ir reta, bet nopietna metabolisma komplikācija, kas var rasties metformīna uzkrāšanās dēļ ārstēšanas laikā ar Janumet; kad tas notiek, aptuveni 50% gadījumu tas ir letāls. Pienskābes acidoze var rasties arī saistībā ar vairākiem patofizioloģiskiem stāvokļiem, ieskaitot cukura diabētu, kā arī vienmēr, kad ir ievērojama audu hipoperfūzija un hipoksēmija. Laktacidozei raksturīgs paaugstināts laktātu līmenis asinīs (> 5 mmol / L), pazemināts pH līmenis asinīs, elektrolītu līmeņa traucējumi ar palielinātu anjonu plaisu un palielināta laktāta / piruvāta attiecība. Ja metformīns ir laktātacidozes cēlonis, parasti tiek konstatēts metformīna līmenis plazmā> 5 ¼ μg / ml.
Ziņots par laktacidozes biežumu pacientiem, kuri saņem metformīna hidrohlorīdu, ir ļoti mazs (aptuveni 0,03 gadījumi uz 1000 pacienta gadiem, ar aptuveni 0,015 nāvējošiem gadījumiem / 1000 pacienta gadi). Vairāk nekā 20 000 pacienta gadu metformīna iedarbībā klīniskajos pētījumos nebija ziņojumu par laktacidozi. Ziņotie gadījumi galvenokārt ir bijuši diabēta pacientiem ar ievērojamu nieru mazspēju, ieskaitot abus raksturīgos nierus slimība un nieru hipoperfūzija, bieži vien vienlaikus ar vairākām vienlaicīgām medicīniskām / ķirurģiskām problēmām un vairākām vienlaikus medikamenti. Pacienti ar sastrēguma sirds mazspēju, kuriem nepieciešama farmakoloģiska vadība, jo īpaši pacienti ar nestabilu vai akūta sastrēguma sirds mazspēja, kurai ir hipoperfūzijas un hipoksēmijas risks, ir paaugstināts pienskābes risks acidoze. Pienskābes acidozes risks palielinās līdz ar nieru disfunkcijas pakāpi un pacienta vecumu. Tādēļ pienskābes acidozes risku var ievērojami samazināt, regulāri kontrolējot nieru darbību pacientiem, kuri lieto metformīnu, un lietojot minimālo efektīvo metformīna devu. Jo īpaši vecāka gadagājuma cilvēku ārstēšana jāpapildina ar rūpīgu nieru darbības uzraudzību. Ārstēšanu ar metformīnu nedrīkst uzsākt pacientiem vecumā no 80 gadiem, ja nav izmērīts kreatinīna klīrenss pierāda, ka nieru darbība nav samazināta, jo šie pacienti ir jutīgāki pret laktacidozes attīstību. Turklāt metformīna lietošana nekavējoties jāpārtrauc, ja ir kādi apstākļi, kas saistīti ar hipoksēmiju, dehidratāciju vai sepsi. Tā kā traucēta aknu darbība var ievērojami ierobežot laktāta attīrīšanas spēju, pacientiem ar aknu slimības klīniskiem vai laboratoriskiem pierādījumiem jāizvairās no metformīna lietošanas. Lietojot metformīnu, pacienti jābrīdina par pārmērīgu akūta vai hroniska alkohola lietošanu, jo alkohols pastiprina metformīna hidrohlorīda iedarbību uz laktātu metabolismu. Turklāt metformīns uz laiku jāpārtrauc pirms jebkura intravaskulāra radiokontrastēšanas pētījuma un jebkuras ķirurģiskas procedūras [skatīt Brīdinājumi un piesardzība].
Pienskābes acidozes sākums bieži ir smalks, un to papildina tikai nespecifiski simptomi, piemēram, savārgums, mialģijas, elpošanas traucējumi, pieaugoša miegainība un nespecifisks vēdera ciešanas. Var būt saistīta hipotermija, hipotensija un izturīgas bradiaritmijas ar izteiktāku acidozi. Pacientam un pacienta ārstam jāzina par šādu simptomu iespējamo nozīmīgumu, un pacientam jāiesaka nekavējoties informēt ārstu, ja tie rodas [skatīt Brīdinājumi un piesardzība]. Metformīns jāatsauc, līdz situācija tiek noskaidrota. Var būt noderīgi elektrolītu līmeņi serumā, ketoni, glikozes līmenis asinīs un, ja norādīts, pH līmenis asinīs, laktātu līmenis un pat metformīna līmenis asinīs. Kad pacienta stāvoklis ir stabilizējies jebkurā metformīna devā, maz ticams, ka kuņģa-zarnu trakta simptomi, kas bieži sastopami terapijas sākumā, ir saistīti ar zālēm. Kuņģa-zarnu trakta simptomu parādīšanās vēlāk varētu būt saistīta ar laktacidozi vai citu nopietnu slimību.
Ātrās venozās plazmas laktāta līmenis virs normas augšējās robežas, bet mazāks par 5 mmol / L pacientiem, kuri lieto metformīnu, nebūt nenozīmē gaidāmo pienskābes līmeni acidoze, un to var izskaidrot ar citiem mehānismiem, piemēram, slikti kontrolētu diabētu vai aptaukošanos, enerģiskām fiziskām aktivitātēm vai tehniskām problēmām paraugu apstrādē [skat Brīdinājumi un piesardzība].
Jebkuram diabēta pacientam ar metabolisko acidozi, ja nav pierādījumu par ketoacidozi (ketonūrija un ketonēmija), vajadzētu būt aizdomām par laktacidozi.
Pienskābes acidoze ir ārkārtas medicīniska problēma, kas jāārstē slimnīcā. Pacientam ar laktacidozi, kurš lieto metformīnu, zāļu lietošana nekavējoties jāpārtrauc un nekavējoties jāuzsāk vispārējie atbalsta pasākumi. Tā kā metformīna hidrohlorīds ir dializējams (ar labu hemodinamiku ar klīrensu līdz 170 ml / min) nosacījumi), lai koriģētu acidozi un noņemtu uzkrāto, ieteicams veikt tūlītēju hemodialīzi metformīns. Šāda pārvaldība bieži izraisa simptomu tūlītēju atcelšanu un atveseļošanos [sk Kontrindikācijas; Brīdinājumi un piesardzība].
Aknu darbības traucējumi
Tā kā aknu darbības traucējumi ir bijuši saistīti ar dažiem laktacidozes gadījumiem, pacientiem ar klīniskiem vai laboratoriskiem aknu slimību pierādījumiem Janumet parasti jāizvairās.
Nieru darbības novērtējums
Ir zināms, ka metformīns un sitagliptīns galvenokārt izdalās caur nierēm. Ar nieru funkcijas traucējumiem palielinās metformīna uzkrāšanās un pienskābes acidozes risks. Tādējādi pacienti, kuriem kreatinīna līmenis serumā pārsniedz viņu vecuma normas augšējo robežu, nedrīkst lietot Janumet. Gados vecākiem cilvēkiem Janumet rūpīgi jā titrē, lai noteiktu minimālo devu pietiekamam glikēmiskajam efektam, jo novecošanās var būt saistīta ar samazinātu nieru darbību. [Skatīt Brīdinājumi un piesardzība un Lietošana īpašās populācijās.]
Pirms Janumet terapijas sākšanas un vismaz reizi gadā nieru darbība jānovērtē un jāpārbauda kā normāla. Pacientiem, kuriem ir paredzēta nieru disfunkcijas attīstība, īpaši gados vecākiem pacientiem, nieru darbība Ja nieru darbības traucējumi ir pierādīti, Janumet darbība jānovērtē biežāk un Janumet lietošana jāpārtrauc klāt.
B vitamīns12 Līmeņi
Kontrolētos klīniskos pētījumos ar metformīna ilgumu 29 nedēļas ilga līdz normāla līmeņa B vitamīna līmeņa pazemināšanās līdz normālam līmenim12 līmenis bez klīniskām izpausmēm tika novērots aptuveni 7% pacientu. Šāds samazinājums, iespējams, traucējumu dēļ B12 absorbcija no B12- iekšējo faktoru komplekss, tomēr ļoti reti ir saistīts ar anēmiju un, šķiet, ir ātri atgriezenisks, pārtraucot metformīna vai B vitamīna lietošanu12 papildināšana. Janumet pacientiem ieteicams katru gadu mērīt hematoloģiskos parametrus, un visas iespējamās novirzes ir attiecīgi jāizmeklē un jāpārvalda. [Skatīt Nevēlamās reakcijas.]
Daži cilvēki (tie, kuriem ir nepietiekams B vitamīns12 vai kalcija uzņemšana vai absorbcija), šķiet, ir predisponēta subnormāla B vitamīna veidošanai12 līmeņi. Šiem pacientiem parastais seruma B vitamīns12 var būt noderīgi mērījumi ar divu līdz trīs gadu intervālu.
Alkohola uzņemšana
Ir zināms, ka alkohols pastiprina metformīna iedarbību uz laktātu metabolismu. Tādēļ Janumet lietošanas laikā pacienti jābrīdina par pārmērīgu akūtu vai hronisku alkohola lietošanu.
Ķirurģiskās procedūras
Janumet lietošana uz laiku jāpārtrauc jebkurai ķirurģiskai procedūrai (izņemot nelielas procedūras, kas nav saistītas ar ierobežotu uzņemšanu) pārtiku un šķidrumus), un to nedrīkst atsākt, kamēr pacienta iekšķīga lietošana nav atsākta un nieru darbība ir novērtēta kā normāli.
Klīniskā stāvokļa izmaiņas pacientiem ar iepriekš kontrolētu 2. tipa cukura diabētu
Pacients ar 2. tipa cukura diabētu, kuru iepriekš labi kontrolēja Janumet, kuram attīstās laboratoriskas vai klīniskas novirzes slimība (īpaši neskaidra un slikti definēta slimība) nekavējoties jānovērtē, lai noteiktu ketoacidozes vai pienskābes pazīmes acidoze. Novērtējumā jāiekļauj elektrolītu un ketonu līmenis serumā, glikozes līmenis asinīs un, ja norādīts, pH līmenis asinīs, laktāta, piruvāta un metformīna līmenis. Ja rodas jebkuras formas acidoze, Janumet lietošana nekavējoties jāpārtrauc un jāuzsāk citi atbilstoši koriģējošie pasākumi.
Lietošana kopā ar medikamentiem, kas zināmi izraisa hipoglikēmiju
Sitagliptīns
Kā parasti ar citiem antihiperglikēmiskiem līdzekļiem, ko lieto kombinācijā ar sulfonilurīnvielu, ja sitagliptīnu lietoja kombinācijā ar metformīnu un sulfonilurīnvielas atvasinājumu, zāles, par kurām zināms, ka tās izraisa hipoglikēmiju, hipoglikēmijas biežums tika palielināts salīdzinājumā ar placebo kombinācijā ar metformīnu un sulfonilurīnviela [sk Nevēlamās reakcijas]. Tādēļ pacientiem, kas saņem arī insulīna sekrēgumu (piemēram, sulfonilurīnvielu, meglitinīdu), var būt nepieciešama mazāka insulīna sekrēcijas deva, lai samazinātu hipoglikēmijas risku [skatīt Devas un ievadīšana].
Metformīna hidrohlorīds
Hipoglikēmija nenotiek pacientiem, kuri saņem tikai metformīnu parastos lietošanas apstākļos, bet tā var rasties, ja nepietiekams kaloriju daudzums, ja intensīvu vingrinājumu nevar kompensēt ar kaloriju papildināšanu vai vienlaicīgas lietošanas laikā ar citiem glikozes līmeni pazeminošiem līdzekļiem (piemēram, sulfonilurīnvielas atvasinājumiem un insulīnu) vai etanolu. Gados vecāki cilvēki, novājināti vai nepietiekami baroti pacienti, kā arī pacienti ar virsnieru vai hipofīzes nepietiekamību vai alkohola intoksikāciju ir īpaši jutīgi pret hipoglikēmisko iedarbību. Hipoglikēmiju var būt grūti atpazīt gados vecākiem cilvēkiem un cilvēkiem, kuri lieto β adrenerģiskus bloķējošus medikamentus.
Vienlaicīgas zāles, kas ietekmē nieru darbību vai metformīna izdalīšanos
Vienlaicīgas zāles, kas var ietekmēt nieru darbību vai izraisīt būtiskas hemodinamiskas izmaiņas vai var traucē metformīna izdalīšanos, piemēram, katjonu zāles, kas tiek izvadītas caur nieru kanāliņu sekrēciju [skat Mijiedarbība ar zālēm], jālieto piesardzīgi.
Radioloģiski pētījumi ar intravaskulāri jodētiem kontrasta materiāliem
Intravaskulāri kontrasta pētījumi ar joda materiāliem (piemēram, intravenozas urogrammas, intravenozas holangiogrāfijas, angiogrāfijas un datortomogrāfijas (CT) skenēšana ar intravaskulāriem kontrastvielām) var izraisīt akūtas nieru funkcijas izmaiņas un ir saistītas ar laktacidozi pacientiem, kuri saņem metformīnu [skatīt Kontrindikācijas]. Tāpēc pacientiem, kuriem tiek plānots šāds pētījums, Janumet lietošana uz laiku vai pirms tā ir jāpārtrauc. pēc 48 stundām pēc procedūras, un to atsāk tikai pēc tam, kad nieru darbība ir atkārtoti novērtēta un konstatēta būt normālam.
Hipoksiski stāvokļi
Sirds un asinsvadu sabrukums (šoks) neatkarīgi no cēloņa, akūta sastrēguma sirds mazspēja, akūts miokarda infarkts un citi apstākļi, kam raksturīga hipoksēmija, ir bijuši saistīti ar laktacidozi, un tie var izraisīt arī prerenālu azotēmija. Ja šādi gadījumi rodas pacientiem, kuri saņem Janumet terapiju, zāļu lietošana nekavējoties jāpārtrauc.
Zaudējums par glikozes līmeņa asinīs kontroli
Ja pacients, kura stāvoklis ir stabilizēts pēc jebkura diabēta režīma, ir pakļauts stresam, piemēram, drudzim, traumai, infekcijai vai operācijai, īslaicīgi var samazināties glikēmijas kontrole. Šādos gadījumos var būt nepieciešams pārtraukt Janumet lietošanu un īslaicīgi ievadīt insulīnu. Janumet var atjaunot pēc akūtas epizodes izzušanas.
Paaugstinātas jutības reakcijas
Pēcreģistrācijas periodā ir saņemti ziņojumi par nopietnām paaugstinātas jutības reakcijām pacientiem, kuri ārstēti ar sitagliptīnu, kas ir viens no Janumet komponentiem. Šīs reakcijas ir anafilakse, angioneirotiskā tūska un eksfoliatīvi ādas apstākļi, ieskaitot Stīvensa-Džonsona sindromu. Tā kā par šīm reakcijām brīvprātīgi ziņo no nenoteikta lieluma populācijas, parasti tā ir nav iespējams ticami novērtēt to biežumu vai noteikt cēloņsakarību ar zāļu iedarbību. Šīs reakcijas sākās pirmo 3 mēnešu laikā pēc sitagliptīna terapijas uzsākšanas, daži ziņojumi notika pēc pirmās devas. Ja ir aizdomas par paaugstinātas jutības reakciju, jāpārtrauc Janumet lietošana, jānovērtē citi iespējamie notikuma cēloņi un jāuzsāk alternatīva diabēta ārstēšana. [Skatīt Nevēlamās reakcijas.]
Makrovaskulāri iznākumi
Nav klīnisku pētījumu, kas pārliecinoši pierādītu makrovaskulāro risku mazināšanos, lietojot Janumet vai jebkuru citu pretdiabēta līdzekli.
tops
Nevēlamās reakcijas
Klīnisko pētījumu pieredze
Tā kā klīniskie pētījumi tiek veikti ļoti dažādos apstākļos, blakusparādību biežums, kas novērots a Šīs zāles nevar tieši salīdzināt ar rādītājiem citas zāles klīniskajos pētījumos, un tās var neatspoguļot rādītājus, kas novēroti prakse.
Sitagliptīna un metformīna vienlaicīga lietošana pacientiem ar 2. tipa cukura diabētu, kuru uzturs un fiziskā slodze nav pietiekami kontrolēta
1. tabulā ir apkopotas visbiežāk sastopamās (¥ ‰% 5% pacientu) blakusparādības (neatkarīgi no izmeklētāja cēloņsakarības novērtējuma) 24 nedēļu laikā placebo kontrolēts faktoriālais pētījums, kurā sitagliptīns un metformīns tika lietoti vienlaikus pacientiem ar 2. tipa cukura diabētu, kuru diēta nebija pietiekami kontrolēta un vingrošana.
1. tabula: Sitagliptīns un metformīns vienlaikus lietojot pacientiem ar 2. tipa cukura diabētu, kuru uzturs un fiziskā slodze nav pietiekami kontrolēta: nelabvēlīgas reakcijas Ziņots (neatkarīgi no izmeklētāja cēloņsakarības novērtējuma)%%% 5% pacientu, kuri saņem kombinēto terapiju (un vairāk nekā pacientiem, kuri saņem Placebo) *
| Pacientu skaits (%) | ||||
Placebo |
Sitagliptīns 100 mg QD |
Metformīns 500 mg / Metformīns 1000 mg divas reizes dienā†|
Sitagliptīns 50 mg divreiz Metformīns 500 mg / Metformīns 1000 mg divas reizes dienā†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Caureja | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infekcija augšējā elpošanas ceļā | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| Galvassāpes | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Sitagliptīna papildterapija pacientiem ar 2. tipa cukura diabētu, kuru nepietiekami kontrolē tikai ar metformīnu
24 nedēļu placebo kontrolētā pētījumā, lietojot 100 mg sitagliptīna vienu reizi dienā, pievienojot metformīna shēmu divreiz dienā, nebija Nevēlamās blakusparādības, par kurām ziņots neatkarīgi no pētnieka novērtējuma par cēloņsakarībām 5% pacientu un biežāk nekā pacientiem, kuriem placebo. Terapijas pārtraukšana klīnisko blakusparādību dēļ bija līdzīga placebo terapijas grupai (sitagliptīns un metformīns, 1,9%; placebo un metformīns, 2,5%).
Hipoglikēmija
Hipoglikēmijas blakusparādības balstījās uz visiem ziņojumiem par hipoglikēmiju; vienlaikus glikozes mērīšana nebija nepieciešama. Kopumā iepriekš noteiktu hipoglikēmijas blakusparādību biežums pacientiem ar 2. tipa cukura diabētu, kuru uzturu un fizisko aktivitāti nepietiekami kontrolēja, bija 0,6% pacientiem, kuri saņēma placebo, 0,6% pacientu, kuri saņēma tikai sitagliptīnu, 0,8% pacientu, kuri saņēma tikai metformīnu, un 1,6% pacientu, kuri saņēma sitagliptīnu kombinācijā ar metformīns. Pacientiem ar 2. tipa cukura diabētu, kuru nepietiekami kontrolē tikai ar metformīnu, kopējais nevēlamo blakusparādību biežums hipoglikēmijas reakcijas bija 1,3% pacientiem, kuriem papildus tika pievienots sitagliptīns, un 2,1% pacientiem, kuriem tika pievienots papildinājums placebo.
Kuņģa-zarnu trakta blakusparādības
Iepriekš atlasītas nelabvēlīgas kuņģa-zarnu trakta pieredzes biežums pacientiem, kuri tika ārstēti ar sitagliptīnu un metformīnu, bija līdzīgi tiem, par kuriem ziņots pacientiem, kuri tika ārstēti tikai ar metformīnu. Skatīt 2. tabulu.
2. tabula: Iepriekš atlasītas kuņģa un zarnu trakta blakusparādības (neatkarīgi no izmeklētāja cēloņsakarības novērtējuma), par kurām ziņots pacientiem ar 2. tipa cukura diabētu, kuri saņem sitagliptīnu un metformīnu.
| Pacientu skaits (%) | ||||||
| Sitagliptīna un metformīna pētījums pacientiem, kuru kontrole nav pietiekama par diētu un vingrinājumiem |
Pētījums par Sitagliptīna papildinājumu pacientiem, kuru kontroli nepietiekami kontrolē tikai ar metformīnu | |||||
Placebo |
Sitagliptīns 100 mg QD |
Metformīns 500 mg / Metformīns 1000 mg divas reizes dienā* |
Sitagliptīns 50 mg divreiz Metformīns 500 mg / Metformīns 1000 mg divas reizes dienā* |
Placebo un metformīns â ‰ ¥ 1500 mg dienā |
Sitagliptīns 100 mg QD un metformīns â ‰ ¥ 1500 mg dienā |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Caureja | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| Slikta dūša | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| Vemšana | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Sāpes vēderā†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptīns kombinācijā ar metformīnu un glimepirīdu
24 nedēļu placebo kontrolētā pētījumā ar 100 mg sitagliptīna kā papildterapijas līdzekļiem pacientiem ar 2. tipa cukura diabētu nepietiekami kontrolēja metformīnu un glimepirīdu (sitagliptīns, N = 116; placebo, N = 113), ziņotās blakusparādības neatkarīgi no pētnieka novērtējuma par cēloņsakarību 5% pacientu ārstēti ar sitagliptīnu un biežāk nekā ar placebo ārstēti pacienti bija: hipoglikēmija (sitagliptīns, 16,4%; placebo, 0,9%) un galvassāpes (6,9%, 2,7%).
Lietojot sitagliptīna un metformīna kombināciju, netika novērotas klīniski nozīmīgas dzīvības pazīmju vai EKG izmaiņas (ieskaitot QTc intervālu).
Visizplatītākā sitagliptīna monoterapijas blakusparādība, par ko ziņots neatkarīgi no pētnieka cēloņsakarības novērtējums bija%%% 5% pacientu un biežāk nekā pacientiem, kuriem tika dota placebo nazofaringīts.
Biežākās (> 5%) konstatētās nevēlamās blakusparādības, kas saistītas ar metformīna terapijas sākšanu, ir caureja, slikta dūša / vemšana, vēdera uzpūšanās, diskomforts vēderā, gremošanas traucējumi, astēnija un galvassāpes.
Laboratorijas testi
Sitagliptīns
Laboratorisko blakusparādību biežums bija līdzīgs pacientiem, kuri tika ārstēti ar sitagliptīnu un metformīnu (7,6%), salīdzinot ar pacientiem, kuri tika ārstēti ar placebo un metformīnu (8,7%). Lielākajā daļā, bet ne visos pētījumos neliels balto asins šūnu skaita pieaugums (aptuveni 200 šūnas / mikrolitrālas atšķirības WBC salīdzinājumā ar placebo; tika novērots vidējais sākotnējais WBC apmēram 6600 šūnas / mikrolitrs) neliela neitrofilu skaita palielināšanās dēļ. Šīs laboratorisko parametru izmaiņas neuzskata par klīniski nozīmīgām.
Metformīna hidrohlorīds
Kontrolētos klīniskos pētījumos ar metformīna ilgumu 29 nedēļas ilga līdz normāla līmeņa B vitamīna līmeņa pazemināšanās līdz normālam līmenim12 līmenis bez klīniskām izpausmēm tika novērots aptuveni 7% pacientu. Šāds samazinājums, iespējams, traucējumu dēļ B12 absorbcija no B12- iekšējo faktoru komplekss, tomēr ļoti reti ir saistīts ar anēmiju un, šķiet, ir ātri atgriezenisks, pārtraucot metformīna vai B vitamīna lietošanu12 papildināšana. [Skatīt Brīdinājumi un piesardzība.]
Pēctirdzniecības pieredze
Janumet vai sitagliptīna, kas ir viena no Janumet sastāvdaļām, lietošanas laikā pēc apstiprināšanas ir identificētas šādas papildu blakusparādības. Tā kā par šīm reakcijām brīvprātīgi ziņo no nenoteikta lieluma populācijas, parasti tā ir nav iespējams ticami novērtēt to biežumu vai noteikt cēloņsakarību ar zāļu iedarbību.
Paaugstinātas jutības reakcijas ir anafilakse, angioneirotiskā tūska, izsitumi, nātrene, ādas vaskulīts un eksfoliatīvi ādas apstākļi, ieskaitot Stīvensa-Džonsona sindromu [skatīt Brīdinājumi un piesardzība]; augšējo elpceļu infekcija; aknu enzīmu līmeņa paaugstināšanās; pankreatīts.
tops
Mijiedarbība ar zālēm
Katjonu zāles
Katjonu zāles (piemēram, amilorīds, digoksīns, morfīns, prokainamīds, hinidīns, hinīns, ranitidīns, triamterēns, trimetoprims vai vankomicīns), kas ir nieru kanāliņu sekrēcijas ceļā teorētiski ir iespējama mijiedarbība ar metformīnu, konkurējot par parasto nieru kanāliņu transportu sistēmas. Šāda mijiedarbība starp metformīnu un perorāli lietojamu cimetidīnu novērota veseliem veseliem brīvprātīgajiem gan ar metformīna-cimetidīna vienreizējām, gan vairākām devām zāļu mijiedarbības pētījumi ar metformīna maksimālās koncentrācijas palielināšanos plazmā un asinīs par 60% un metformīna paaugstināšanos plazmā un asinīs par 40% AUC. Vienu devu pētījumā eliminācijas pusperiods nemainījās. Metformīns neietekmēja cimetidīna farmakokinētiku. Kaut arī šāda mijiedarbība joprojām ir teorētiska (izņemot cimetidīnu), rūpīga pacienta uzraudzība un Janumet un / vai traucējošas zāles ir ieteicamas pacientiem, kuri lieto katjonu medikamentus, kas izdalās caur proksimālo nieru kanāliņu sekrēciju sistēma.
Digoksīns
Nedaudz palielinājās laukums zem līknes (AUC, 11%) un vidējā zāļu maksimālā koncentrācija (Cmaks, 18%) digoksīna, vienlaikus lietojot 100 mg sitagliptīna 10 dienas. Šie pieaugumi netiek uzskatīti par klīniski nozīmīgiem. Digoksīnam kā katjonu zālēm ir iespēja konkurēt ar metformīnu par kopīgām nieru kanāliņu transporta sistēmām, tādējādi ietekmējot vai nu digoksīna, metformīna, vai abu koncentrāciju serumā. Pacienti, kas saņem digoksīnu, ir atbilstoši jāuzrauga. Digoksīna vai Janumet devas nav ieteicams pielāgot.
Glyburide
Vienu devu mijiedarbības pētījumā ar 2. tipa cukura diabēta pacientiem metformīna un glicurīda vienlaicīga lietošana nemainīja ne metformīna farmakokinētiku, ne farmakodinamiku. Glikurīda AUC un C līmeņa pazemināšanāsmaks tika novēroti, bet bija ļoti mainīgi. Šī pētījuma vienas devas raksturs un korelācijas trūkums starp glicurīda līmeni asinīs un farmakodinamisko iedarbību padara šīs mijiedarbības klīnisko nozīmi nenoteiktu.
Furosemīds
Vienreizējas devas metformīna-furosemīda zāļu mijiedarbības pētījums ar veseliem cilvēkiem parādīja, ka vienlaicīga lietošana ietekmē abu savienojumu farmakokinētiskos parametrus. Furosemīds palielināja metformīna plazmu un C līmeni asinīsmaks par 22% un AUC asinīs par 15%, bez būtiskām izmaiņām metformīna nieru klīrensā. Lietojot kopā ar metformīnu, Cmaks furosemīda un AUC bija attiecīgi par 31% un 12% mazāki nekā, lietojot atsevišķi, un terminālais eliminācijas pusperiods tika samazināts par 32%, bez būtiskām izmaiņām furosemīda nierēs klīrenss. Nav pieejama informācija par metformīna un furosemīda mijiedarbību, ja to hroniski lieto vienlaikus.
Nifedipīns
Vienreizējas devas metformīna-nifedipīna zāļu mijiedarbības pētījums ar veseliem veseliem brīvprātīgajiem parādīja, ka vienlaikus nifedipīna lietošana palielina metformīna C līmeni plazmā.maks un AUC attiecīgi par 20% un 9% un palielināja urīnā izdalīto daudzumu. Tmaks un pusperiods netika ietekmēts. Šķiet, ka nifedipīns uzlabo metformīna absorbciju. Metformīnam bija minimāla ietekme uz nifedipīnu.
Metformīna lietošana kopā ar citām zālēm
Dažas zāles mēdz izraisīt hiperglikēmiju un var izraisīt glikēmijas kontroles zaudēšanu. Šīs zāles ietver tiazīdus un citus diurētiskos līdzekļus, kortikosteroīdus, fenotiazīnus, vairogdziedzera produktus, estrogēni, perorālie kontracepcijas līdzekļi, fenitoīns, nikotīnskābe, simpatomimētiskie līdzekļi, kalcija kanālu bloķējoši medikamenti un izoniazīds. Ja šādas zāles tiek ordinētas pacientam, kurš saņem Janumet, pacients ir rūpīgi jānovēro, lai uzturētu pietiekamu glikēmijas kontroli.
Veseliem brīvprātīgajiem vienreizējas devas mijiedarbības pētījumos metformīna un propranolola, kā arī metformīna un ibuprofēna farmakokinētiku neietekmēja.
Metformīns ir nenozīmīgi saistīts ar plazmas olbaltumvielām, tāpēc tas ir mazāk ticams, ka mijiedarbosies ar tādām zālēm, kas lielā mērā saistās ar olbaltumvielām, piemēram, salicilāti, sulfonamīdi, hloramfenikols un probenecīds, salīdzinot ar sulfonilurīnvielām, kuras plaši saistās ar serumu olbaltumvielas.
tops
Lietošana īpašās populācijās
Grūtniecība
Grūtniecības kategorija B:
Janumets
Nav adekvātu un labi kontrolētu pētījumu par grūtniecēm ar Janumet vai tā atsevišķām sastāvdaļām; tāpēc Janumet drošība grūtniecēm nav zināma. Janumet grūtniecības laikā drīkst lietot tikai tad, ja tas ir absolūti nepieciešams.
Merck & Co., Inc. uztur reģistru, lai uzraudzītu Janumet pakļauto sieviešu grūtniecības rezultātus grūtniecības laikā. Veselības aprūpes sniedzēji tiek aicināti ziņot par jebkuru Janumet pirmsdzemdību iedarbību, zvanot uz Grūtniecības reģistru pa tālruni (800) 986-8999.
Janumet, izmantojot kombinētos produktus, nav veikti pētījumi ar dzīvniekiem, lai novērtētu ietekmi uz reprodukciju. Šie dati ir balstīti uz atklājumiem pētījumos, kas veikti ar sitagliptīnu vai metformīnu atsevišķi.
Sitagliptīns
Reprodukcijas pētījumi veikti ar žurkām un trušiem. Sitagliptīna devas līdz 125 mg / kg (aptuveni 12 reizes pārsniedzot iedarbību uz cilvēku, lietojot maksimālo ieteicamo devu cilvēkam), nepasliktināja auglību un nekaitēja auglim. Tomēr nav piemērotu un labi kontrolētu pētījumu ar sitagliptīnu grūtniecēm.
Sitagliptīns, ko lietoja grūsnām žurku mātītēm un trušiem no 6. līdz 20. grūtniecības dienai (organoģenēze), nebija perorāli lietojamo devu līdz 250 mg / kg teratogēns. (žurkas) un 125 mg / kg (truši) vai aptuveni 30 un 20 reizes pārsniedz iedarbību uz cilvēku ar maksimālo ieteicamo devu (MRHD) 100 mg / dienā, pamatojoties uz AUC salīdzinājumi. Lielākas devas palielināja ribu malformāciju biežumu pēcnācējiem, lietojot 1000 mg / kg vai aptuveni 100 reizes lielāku iedarbību uz cilvēku, lietojot MRHD.
Sitagliptīns, ko lietoja žurku mātītēm no 6. grūtniecības līdz 21. laktācijas dienai, samazināja vīriešu un sieviešu pēcnācēju ķermeņa svaru ar devu 1000 mg / kg. Žurku pēcnācējiem netika novērota funkcionālā vai uzvedības toksicitāte.
Grūtniecēm žurkām ievadītā sitagliptīna pārnešana placentā bija aptuveni 45% pēc 2 stundām un 80% pēc 24 stundām pēc devas. Grūtīgiem trušiem ievadītā sitagliptīna transplantācija placentā bija aptuveni 66% pēc 2 stundām un 30% pēc 24 stundām.
Metformīna hidrohlorīds
Metformīns nebija teratogēns žurkām un trušiem, lietojot devas līdz 600 mg / kg dienā. Balstoties uz attiecīgi žurku un trušu ķermeņa virsmas laukuma salīdzinājumu, tā iedarbība ir aptuveni 2 un 6 reizes lielāka par maksimālo ieteicamo cilvēka dienas devu 2000 mg. Augļa koncentrācijas noteikšana parādīja daļēju placentas barjeru metformīnam.
Barojošās mātes
Nav veikti pētījumi ar dzīvniekiem zīdīšanas periodā ar Janumet kombinētajiem komponentiem. Pētījumos, kas veikti ar atsevišķām sastāvdaļām, gan sitagliptīns, gan metformīns izdalās žurku zīdīšanas periodā. Nav zināms, vai sitagliptīns izdalās mātes pienā. Tā kā daudzas zāles izdalās mātes pienā, Janumet jāievada piesardzīgi sievietēm, kas baro bērnu ar krūti.
Lietošana bērniem
Janumet drošība un efektivitāte bērniem, kas jaunāki par 18 gadiem, nav noteikta.
Geriatriska lietošana
Janumets
Tā kā sitagliptīns un metformīns lielā mērā izdalās caur nierēm un novecošanās var būt saistīta ar samazinātu nieru darbību, Janumet jālieto piesardzīgi, palielinoties vecumam. Izvēloties devu, jāievēro piesardzība, un tās pamatā jābūt rūpīgai un regulārai nieru darbības kontrolei. [Skatīt Brīdinājumi un piesardzība; Klīniskā farmakoloģija.]
Sitagliptīns
No kopējā subjektu skaita (N = 3884) sitagliptīna II un III fāzes klīniskajos pētījumos 725 pacienti bija 65 gadus veci un vecāki, savukārt 61 pacients bija 75 gadus veci un vecāki. Starp 65 gadus veciem un vecākiem cilvēkiem un jaunākiem indivīdiem netika novērotas vispārējas drošības vai efektivitātes atšķirības. Lai gan šī un cita ziņotā klīniskā pieredze nav identificējusi atbildes reakcijas atšķirības starp gados vecākiem un jaunākiem pacientiem lielāka vecāku cilvēku jutība nevar būt izslēgts.
Metformīna hidrohlorīds
Kontrolētos klīniskajos metformīna pētījumos nebija iekļauts pietiekams skaits gados vecāku pacientu, lai noteiktu, vai viņi reaģē atšķirīgi no jaunākiem pacientiem, lai gan cita ziņotā klīniskā pieredze nav atklājusi atšķirības atbildes reakcijā starp gados vecākiem un jauniem pacientiem pacientiem. Metformīns jālieto tikai pacientiem ar normālu nieru darbību. Sākotnējai un uzturošai metformīna devai jābūt konservatīvai pacientiem ar paaugstinātu vecumu, jo šajā populācijā var samazināties nieru darbība. Jebkura devas pielāgošana jābalsta uz rūpīgu nieru funkcijas novērtējumu. [Skatīt Kontrindikācijas; Brīdinājumi un piesardzība; un Klīniskā farmakoloģija.]
tops
Pārdozēšana
Sitagliptīns
Kontrolētu klīnisko pētījumu laikā ar veseliem cilvēkiem tika ordinētas vienreizējas sitagliptīna devas līdz 800 mg. Vienā pētījumā, lietojot 800 mg sitagliptīna devu, tika novērots maksimālais vidējais QTc pieaugums par 8,0 ms, kas ir vidējais efekts, ko neuzskata par klīniski nozīmīgu [sk. Klīniskā farmakoloģija]. Nav pieredzes par devām, kas pārsniedz 800 mg cilvēkiem. I fāzes vairāku devu pētījumos ar sitagliptīnu, lietojot devas līdz 400 mg dienā, laika posmā līdz 28 dienām netika novērotas no devas atkarīgas klīniskas blakusparādības.
Pārdozēšanas gadījumā ir saprātīgi veikt parastos atbalsta pasākumus, piemēram, no kuņģa-zarnu trakta noņemt neuzsūcinātu materiālu. traktā, izmanto klīnisko uzraudzību (ieskaitot elektrokardiogrammas iegūšanu) un veic uzturošo terapiju, kā norāda pacienta klīniskais statusu.
Sitagliptīns ir nedaudz dializējams. Klīniskajos pētījumos apmēram 13,5% devas tika izvadīti 3 līdz 4 stundu ilgas hemodialīzes sesijas laikā. Ja klīniski piemērota, var apsvērt ilgstošu hemodialīzi. Nav zināms, vai sitagliptīns var dializēt ar peritoneālās dialīzes palīdzību.
Metformīna hidrohlorīds
Ir notikusi metformīna hidrohlorīda pārdozēšana, ieskaitot daudzumu, kas pārsniedz 50 gramus. Aptuveni 10% gadījumu tika ziņots par hipoglikēmiju, bet cēloņsakarība ar metformīna hidrohlorīdu nav noteikta. Par pienskābo acidozi ziņots apmēram 32% metformīna pārdozēšanas gadījumu [skatīt Brīdinājumi un piesardzība]. Labos hemodinamikas apstākļos metformīns ir dializējams ar klīrensu līdz 170 ml / min. Tādēļ hemodialīze var būt noderīga uzkrāto zāļu noņemšanai no pacientiem, kuriem ir aizdomas par metformīna pārdozēšanu.
tops
Apraksts
Janumet (sitagliptīna / metformīna HCl) tabletes satur divas perorāli lietojamas antihiperglikēmiskas zāles, ko lieto 2. tipa diabēta ārstēšanā: sitagliptīnu un metformīna hidrohlorīdu.
Sitagliptīns
Sitagliptīns ir perorāli aktīvs enzīma dipeptidilpeptidāzes-4 (DPP-4) inhibitors. Sitagliptīns atrodas Janumet tabletēs sitagliptīna fosfāta monohidrāta veidā. Sitagliptīna fosfāta monohidrāts ķīmiski aprakstīts kā 7 - [(3R) - 3-amino-1-okso-4 - (2,4,5 - trifluorfenil) butil] - 5,6,7,8 - tetrahidro-3 - (trifluormetil) -1,2,4 - triazolo [4,3-a] pirazīna fosfāta (1: 1) monohidrāts ar empīrisku formulu no C16H15F6N5O-H3PO4-H2O un molekulmasa 523,32. Strukturālā formula ir:
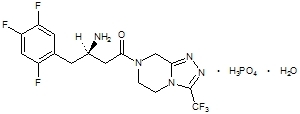
Sitagliptīna fosfāta monohidrāts ir balts vai gandrīz balts, kristālisks, nehigroskopisks pulveris. Tas šķīst ūdenī un N, N-dimetilformamīdā; nedaudz šķīst metanolā; ļoti vāji šķīst etanolā, acetonā un acetonitrilā; un nešķīst izopropanolā un izopropilacetātā.
Metformīna hidrohlorīds
Metformīna hidrohlorīds (N, N-dimetilimidodikarbonimidiskā diamīda hidrohlorīds) nav ķīmiski vai farmakoloģiski saistīts ar citām perorālo antihiperglikēmisko līdzekļu klasēm. Metformīna hidrohlorīds ir balts vai gandrīz balts kristālisks savienojums ar C molekulāro formulu4H11N5-HCl un molekulmasa 165,63. Metformīna hidrohlorīds labi šķīst ūdenī un praktiski nešķīst acetonā, ēterī un hloroformā. PKa metformīna ir 12,4. Metformīna hidrohlorīda 1% ūdens šķīduma pH ir 6,68. Strukturālā formula ir šāda:

Janumets
Janumet ir pieejams iekšķīgai lietošanai tablešu veidā, kas satur 64,25 mg sitagliptīna fosfāta monohidrāta un metformīna hidrohlorīda ekvivalenta līdz: 50 mg sitagliptīna kā brīvas bāzes un 500 mg metformīna hidrohlorīda (Janumet 50 mg / 500 mg) vai 1000 mg metformīna hidrohlorīda (Janumet 50 mg / 1000 mg). Katra Janumet apvalkotā tablete satur šādas neaktīvas sastāvdaļas: mikrokristālisku celulozi, polivinilpirolidonu, nātrija laurilsulfātu un nātrija stearilfumarātu. Turklāt plēves pārklājums satur šādas neaktīvas sastāvdaļas: polivinilspirtu, polietilēnglikolu, talku, titāna dioksīdu, sarkano dzelzs oksīdu un melno dzelzs oksīdu.
tops
Klīniskā farmakoloģija
Darbības mehānisms
Janumets
Janumet apvieno divus antihiperglikēmiskos līdzekļus ar papildinošiem darbības mehānismiem, lai uzlabotu glikēmijas kontroli pacientiem ar 2. tipa cukura diabēts: sitagliptīns, dipeptidilpeptidāzes-4 (DPP-4) inhibitors, un metformīna hidrohlorīds, biguanīda loceklis klase.
Sitagliptīns
Sitagliptīns ir DPP-4 inhibitors, kas, domājams, savu darbību veic pacientiem ar 2. tipa cukura diabētu, palēninot inkretīna hormonu inaktivāciju. Sitagliptīns palielina aktīvo neskarto hormonu koncentrāciju, tādējādi palielinot un pagarinot šo hormonu darbību. Palielinātie hormoni, ieskaitot glikagonam līdzīgo peptīdu-1 (GLP-1) un no glikozes atkarīgo insulinotropo polipeptīds (GIP), zarnās izdalās visu dienu, un, reaģējot uz to, paaugstinās līmenis uz maltīti. Šie hormoni tiek ātri inaktivēti ar enzīmu DPP-4. Inkretini ir daļa no endogēnas sistēmas, kas iesaistīta glikozes homeostāzes fizioloģiskajā regulēšanā. Kad glikozes koncentrācija asinīs ir normāla vai paaugstināta, GLP-1 un GIP palielina insulīna sintēzi un izdalīšanos no aizkuņģa dziedzera beta šūnām, izmantojot intracelulārus signālceļus, iesaistot ciklisku AMP. GLP-1 samazina arī glikagona sekrēciju no aizkuņģa dziedzera alfa šūnām, izraisot samazinātu glikozes ražošanu aknās. Palielinot un pagarinot aktīvo inkretīna līmeni, sitagliptīns palielina insulīna izdalīšanos un samazina glikagona līmeni asinsritē atkarībā no glikozes. Sitagliptīns demonstrē selektivitāti pret DPP-4 un inhibē DPP-8 vai DPP-9 aktivitāti in vitro koncentrācijās, kas ir līdzīgas terapeitisko devu koncentrācijām.
Metformīna hidrohlorīds
Metformīns ir antihiperglikēmisks līdzeklis, kas uzlabo glikozes toleranci pacientiem ar 2. tipa cukura diabētu, pazeminot gan bazālo, gan pēcsēdes glikozes līmeni plazmā. Tās farmakoloģiskie darbības mehānismi atšķiras no citām perorālo antihiperglikēmisko līdzekļu klasēm. Metformīns samazina glikozes ražošanu aknās, samazina glikozes uzsūkšanos zarnās un uzlabo jutību pret insulīnu, palielinot perifēro glikozes uzņemšanu un izmantošanu. Atšķirībā no sulfonilurīnvielas atvasinājumiem metformīns neizraisa hipoglikēmiju ne pacientiem ar 2. tipa cukura diabētu, ne normāliem cilvēkiem (izņemot īpašus apstākļus [sk. Brīdinājumi un piesardzība]) un neizraisa hiperinsulinēmiju. Lietojot metformīnu, insulīna sekrēcija paliek nemainīga, bet insulīna līmenis tukšā dūšā un vienas dienas plazmas insulīna reakcija faktiski var samazināties.
12.2 Farmakodinamika
Sitagliptīns
Vispārīgi
Pacientiem ar 2. tipa cukura diabētu sitagliptīna ievadīšana DPP-4 enzīma aktivitāti inhibēja 24 stundas. Pēc perorālas glikozes slodzes vai ēdienreizēm šī DPP-4 nomākšana izraisīja aktīvās GLP-1 un GIP cirkulācijas līmeņa palielināšanos 2 - 3 reizes, samazināta glikagona koncentrācija un paaugstināta insulīna izdalīšanās jutība pret glikozi, kā rezultātā paaugstinās C-peptīds un insulīns koncentrācijas. Insulīna līmeņa paaugstināšanās līdz ar glikagona līmeņa pazemināšanos bija saistīta ar zemāku glikozes koncentrāciju tukšā dūšā un samazinātu glikozes izdalīšanos pēc perorālas glikozes līmeņa vai ēdienreizes.
Sitagliptīna un metformīna hidrohlorīda vienlaicīga lietošana
Divu dienu ilgā pētījumā ar veseliem cilvēkiem sitagliptīns viens pats palielināja aktīvās GLP-1 koncentrāciju, turpretī metformīns tikai palielināja aktīvo un kopējo GLP-1 koncentrāciju līdzīgā mērā. Sitagliptīna un metformīna vienlaicīgai lietošanai bija papildu ietekme uz aktīvo GLP-1 koncentrāciju. Sitagliptīns, bet ne metformīns, palielināja aktīvo GIP koncentrāciju. Nav skaidrs, ko šie atklājumi nozīmē izmaiņām glikēmijas kontrolē pacientiem ar 2. tipa cukura diabētu.
Pētījumos ar veseliem cilvēkiem sitagliptīns nesamazināja glikozes līmeni asinīs vai neizraisīja hipoglikēmiju.
Sirds elektrofizioloģija
Randomizētā, placebo kontrolētā krusteniskā pētījumā 79 veseliem cilvēkiem tika ievadīta vienreizēja perorāla sitagliptīna deva 100 mg, sitagliptīns 800 mg (8 reizes lielāka par ieteicamo devu) un placebo. Lietojot ieteicamo devu 100 mg, QTc intervālam, kas iegūts pie maksimālās koncentrācijas plazmā, vai jebkurā citā laikā pētījuma laikā nebija nekādas ietekmes. Pēc 800 mg devas maksimālais placebo koriģēto vidējo QTc izmaiņu pieaugums sākotnējā līmenī 3 stundas pēc devas bija 8,0 ms. Šis pieaugums netiek uzskatīts par klīniski nozīmīgu. Lietojot 800 mg devu, maksimālā sitagliptīna koncentrācija plazmā bija aptuveni 11 reizes augstāka nekā maksimālā koncentrācija pēc 100 mg devas.
Pacientiem ar 2. tipa cukura diabētu, lietojot 100 mg sitagliptīna (N = 81) vai 200 mg sitagliptīna (N = 63) katru dienu, balstoties uz EKG datiem, kas iegūti paredzamās maksimālās plazmas laikā, QTc intervālā nebija nozīmīgu izmaiņu koncentrācija.
Farmakokinētika
Janumets
Bioekvivalences pētījuma rezultāti ar veseliem cilvēkiem parādīja, ka Janumet (sitagliptīns / metformīna HCl) 50 mg / 500 mg un 50 mg / 1000 mg kombinētās tabletes ir bioekvivalentas atbilstošo sitagliptīna devu vienlaicīgai lietošanai (JANUVIA™2) un metformīna hidrohlorīdu kā atsevišķas tabletes.
Absorbcija
Sitagliptīns
Sitagliptīna absolūtā biopieejamība ir aptuveni 87%. Vienlaicīga augsta tauku satura maltītes un sitagliptīna lietošana neietekmēja sitagliptīna farmakokinētiku.
Metformīna hidrohlorīds
Metformīna hidrohlorīda 500 mg tabletes absolūtā bioloģiskā pieejamība tukšā dūšā ir aptuveni 50–60%. Pētījumi, izmantojot metformīna hidrohlorīda tablešu vienreizējas perorālas devas no 500 mg līdz 1500 mg un 850 mg līdz 2550 mg, liecina, ka devu proporcionalitātes trūkums, palielinot devas, kas ir saistīts ar samazinātu absorbciju, nevis izmaiņām izdalīšanās laikā. Ēdiens samazina metformīna absorbciju un nedaudz kavē to, kā liecina vidējā maksimālā koncentrācija plazmā par 40% (Cmaks), par 25% zemāks laukums zem plazmas koncentrācijas un laika līknes (AUC) un 35 minūšu pagarinājums līdz maksimālajai koncentrācijai plazmā (Tmaks) pēc vienas 850 mg metformīna tabletes lietošanas kopā ar uzturu, salīdzinot ar tās pašas tabletes stiprumu, ko lieto tukšā dūšā. Šo samazinājumu klīniskā nozīme nav zināma.
Izplatīšana
Sitagliptīns
Vidējais izkliedes tilpums līdzsvara stāvoklī pēc vienreizējas 100 mg sitagliptīna devas ievadīšanas veseliem cilvēkiem ir aptuveni 198 litri. Ar plazmas olbaltumvielām atgriezeniski saistītā sitagliptīna frakcija ir maza (38%).
Metformīna hidrohlorīds
Metformīna šķietamais izkliedes tilpums (V / F) pēc vienreizējām perorālām 850 mg metformīna hidrohlorīda tablešu devām bija vidēji 654 ± 358 L. Metformīns ir nenozīmīgi saistīts ar plazmas olbaltumvielām atšķirībā no sulfonilurīnvielas atvasinājumiem, kas vairāk nekā 90% ir saistīti ar olbaltumvielām. Metformīns sadalās eritrocītos, visticamāk, kā laika funkcija. Parastās metformīna hidrohlorīda tablešu klīniskajās devās un dozēšanas shēmās metformīna līdzsvara koncentrācija plazmā tiek sasniegta 24-48 stundu laikā un parasti ir
Vielmaiņa
Sitagliptīns
Aptuveni 79% sitagliptīna izdalās nemainītā veidā ar urīnu, metabolisms ir neliels eliminācijas ceļš.
Pēc [14C] sitagliptīna perorālā deva, aptuveni 16% radioaktivitātes izdalījās kā sitagliptīna metabolīti. Tika atklāti seši metabolīti mikroelementu līmenī, un nav paredzams, ka tie veicinās sitagliptīna DPP-4 inhibējošo darbību plazmā. In vitro pētījumi parādīja, ka primārais enzīms, kas ir atbildīgs par ierobežotu sitagliptīna metabolismu, bija CYP3A4, kuru veicina CYP2C8.
Metformīna hidrohlorīds
Vienu devu intravenozie pētījumi parastiem cilvēkiem parāda, ka metformīns izdalās nemainītā veidā urīnā un netiek pakļauts metabolismam aknās (metabolīti nav identificēti cilvēkiem) un žults ekskrēcija.
Izdalīšanās
Sitagliptīns
Pēc perorālas ievadīšanas [14C] sitagliptīna deva veseliem cilvēkiem aptuveni 100% no ievadītās radioaktivitātes tika izdalīta ar fekālijām (13%) vai urīnu (87%) vienas nedēļas laikā pēc dozēšanas. Šķietamais terminālis t1/2 pēc 100 mg perorālās sitagliptīna devas bija aptuveni 12,4 stundas, un nieru klīrenss bija aptuveni 350 ml / min.
Sitagliptīna eliminācija galvenokārt notiek caur nierēm un ir saistīta ar aktīvu tubulāru sekrēciju. Sitagliptīns ir cilvēka organiskā anjonu transportētāja-3 (hOAT-3) substrāts, kas var būt iesaistīts sitagliptīna eliminācijā caur nierēm. HOAT-3 klīniskā nozīme sitagliptīna pārvadāšanā nav noskaidrota. Sitagliptīns ir arī p-glikoproteīna substrāts, kas arī var būt iesaistīts sitagliptīna eliminācijas caur nierēm starpniecībā. Tomēr ciklosporīns, p-glikoproteīna inhibitors, nesamazināja sitagliptīna nieru klīrensu.
Metformīna hidrohlorīds
Nieru klīrenss ir aptuveni 3,5 reizes lielāks nekā kreatinīna klīrenss, kas norāda, ka tubulārā sekrēcija ir galvenais metformīna eliminācijas ceļš. Pēc iekšķīgas lietošanas aptuveni 90% absorbēto zāļu tiek izvadīti caur nierēm pirmo 24 stundu laikā, eliminācijas pusperiods no plazmas ir aptuveni 6,2 stundas. Asinis eliminācijas pusperiods ir aptuveni 17,6 stundas, kas liek domāt, ka eritrocītu masa var būt sadalījuma nodalījums.
Īpašās populācijas
Nieru mazspēja
Janumets
Janumet nedrīkst lietot pacienti ar nieru mazspēju [skatīt Kontrindikācijas; Brīdinājumi un piesardzība].
Sitagliptīns
Pacientiem ar mērenu nieru mazspēju tika novērots sitagliptīna AUC palielināšanās plazmā apmēram 2 reizes un aptuveni 4 reizes pieaugums bija novērots pacientiem ar smagu nieru mazspēju, ieskaitot pacientus ar ESRD, kuriem tiek veikta hemodialīze, salīdzinot ar normālu veselīgu kontroli priekšmeti.
Metformīna hidrohlorīds
Pacientiem ar samazinātu nieru darbību (pamatojoties uz izmērīto kreatinīna klīrensu), eliminācijas pusperiods plazmā un asinīs metformīna daudzums tiek pagarināts, un nieru klīrenss tiek samazināts proporcionāli kreatinīna līmeņa samazinājumam klīrenss.
Aknu nepietiekamība
Sitagliptīns
Pacientiem ar mērenu aknu mazspēju (Child-Pugh vērtējums no 7 līdz 9) vidējais AUC un Cmaks sitagliptīna koncentrācija palielinājās attiecīgi par aptuveni 21% un 13%, salīdzinot ar veselīgi kontrolētu kontroli, pēc vienreizējas 100 mg sitagliptīna devas ievadīšanas. Šīs atšķirības netiek uzskatītas par klīniski nozīmīgām.
Nav klīniskas pieredzes pacientiem ar smagu aknu mazspēju (Child-Pugh rādītājs> 9).
Metformīna hidrohlorīds
Metformīna farmakokinētiskie pētījumi pacientiem ar aknu mazspēju nav veikti.
Dzimums
Sitagliptīns
Dzimumam nebija klīniski nozīmīgas ietekmes uz sitagliptīna farmakokinētiku, pamatojoties uz kompozītu I fāzes farmakokinētisko datu analīze un I un II fāzes populācijas farmakokinētiskās analīze dati.
Metformīna hidrohlorīds
Metformīna farmakokinētiskie parametri nozīmīgi neatšķīrās no normāliem indivīdiem un pacientiem ar 2. tipa cukura diabētu, analizējot pēc dzimuma. Tāpat kontrolētos klīniskajos pētījumos ar pacientiem ar 2. tipa cukura diabētu metformīna antihiperglikēmiskais efekts bija salīdzināms vīriešiem un sievietēm.
Geriatric
Sitagliptīns
Ja ņem vērā vecuma ietekmi uz nieru darbību, tikai vecumam nebija klīniski nozīmīga ietekme uz sitagliptīna farmakokinētiku, pamatojoties uz populācijas farmakokinētiku analīze. Gados vecākiem cilvēkiem (no 65 līdz 80 gadiem) sitagliptīna koncentrācija plazmā bija par aptuveni 19% augstāka nekā gados jaunākiem cilvēkiem.
Metformīna hidrohlorīds
Ierobežoti dati par kontrolētiem metformīna farmakokinētiskiem pētījumiem veseliem vecāka gadagājuma cilvēkiem liecina, ka kopējais metformīna klīrenss plazmā ir samazināts, pusperiods ir pagarināts un Cmaks ir palielināts, salīdzinot ar veseliem jauniem cilvēkiem. No šiem datiem izriet, ka metformīna farmakokinētikas izmaiņas ar novecošanos galvenokārt ir saistītas ar nieru funkcijas izmaiņām (skatīt GLUCOPHAGE3 informācija par zāļu izrakstīšanu: KLĪNISKĀ FARMAKOLOĢIJA, Īpašas populācijas, geriatrija).
Ārstēšanu ar Janumet nedrīkst uzsākt pacientiem vecumā no 80 gadiem, ja vien kreatinīna klīrensa mērīšana neuzrāda, ka nieru darbība nav samazināta [skatīt Brīdinājumi un piesardzība].
Pediatrijā
Nav veikti pētījumi ar Janumet bērniem.
Sacensības
Sitagliptīns
Rasei, balstoties uz salikto analīzi, nebija klīniski nozīmīgas ietekmes uz sitagliptīna farmakokinētiku pieejamo farmakokinētisko datu, ieskaitot balto, spāņu, melno, aziātu un citu rasu subjektus grupas.
Metformīna hidrohlorīds
Nav veikti metformīna farmakokinētisko parametru pētījumi pēc rases. Kontrolētos metformīna klīniskajos pētījumos pacientiem ar 2. tipa cukura diabētu antihiperglikēmiskais efekts bija līdzīgs baltumiem (n = 249), melnādainiem (n = 51) un Hispanics (n = 24).
Ķermeņa masas indekss (ĶMI)
Sitagliptīns
Ķermeņa masas indeksam nebija klīniski nozīmīgas ietekmes uz sitagliptīna farmakokinētiku, pamatojoties uz kompozītu I fāzes farmakokinētisko datu analīze un I un II fāzes populācijas farmakokinētiskās analīze dati.
Mijiedarbība ar zālēm
Sitagliptīns un metformīna hidrohlorīds
Vienlaicīga vairāku sitagliptīna (50 mg) un metformīna (1000 mg) devu lietošana divreiz dienā būtiski nemaina ne sitagliptīna, ne metformīna farmakokinētiku pacientiem ar 2. tipu diabēts.
Farmakokinētiskie zāļu mijiedarbības pētījumi ar Janumet nav veikti; tomēr šādi pētījumi tika veikti ar atsevišķiem Janumet komponentiem (sitagliptīnu un metformīna hidrohlorīdu).
Sitagliptīns
Zāļu mijiedarbības in vitro novērtējums
Sitagliptīns nav CYP izozīmu CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 vai 2B6 inhibitors, un tas nav CYP3A4 induktors. Sitagliptīns ir p-glikoproteīna substrāts, bet tas neinhibē digoksīna transportēšanu ar p-glikoproteīnu starpniecību. Balstoties uz šiem rezultātiem, tiek uzskatīts, ka sitagliptīns nevar izraisīt mijiedarbību ar citām zālēm, kuras izmanto šos ceļus.
Sitagliptīns nav plaši saistīts ar plazmas olbaltumvielām. Tāpēc sitagliptīna tieksme iesaistīties klīniski nozīmīgā zāļu mijiedarbībā, ko izraisa plazmas olbaltumvielu saistīšanās pārvietošana, ir ļoti zema.
In vivo zāļu mijiedarbības novērtējums
Sitagliptīna ietekme uz citām zālēm
Klīniskajos pētījumos, kā aprakstīts turpmāk, sitagliptīns nozīmīgi nemainīja metformīna, glicurīda, simvastatīna, rosiglitazona, varfarīna vai perorālo zāļu farmakokinētiku. kontracepcijas līdzekļi, nodrošinot in vivo pierādījumus par zemu tieksmi izraisīt zāļu mijiedarbību ar CYP3A4, CYP2C8, CYP2C9 substrātiem un organisko katjonu nesēju (AZT).
Digoksīns: Sitagliptīnam bija minimāla ietekme uz digoksīna farmakokinētiku. Pēc 0,25 mg digoksīna ievadīšanas vienlaicīgi ar 100 mg sitagliptīna dienā 10 dienas, digoksīna plazmas AUC palielinājās par 11%, bet Cmaks par 18%.
Sulfonilurīnvielas atvasinājumi: CYP2C9 substrāta glicurīda vienas devas farmakokinētika indivīdiem, kuri saņēma vairākas sitagliptīna devas, nozīmīgi nemainījās. Nav gaidāma klīniski nozīmīga mijiedarbība ar citiem sulfonilurīnvielas atvasinājumiem (piemēram, glipizīdu, tolbutamīdu un glimepirīdu), kurus, tāpat kā glicurīdu, galvenokārt izvada CYP2C9 [skatīt Brīdinājumi un piesardzība].
Simvastatīns: Simvastatīna, CYP3A4 substrāta, vienreizējas devas farmakokinētika indivīdiem, kuri saņēma vairākas sitagliptīna dienas devas, nemainījās. Tāpēc sitagliptīns nav CYP3A4 starpniecības metabolisma inhibitors.
Tiazolidīndioni: Rosiglitazona vienas devas farmakokinētika indivīdiem nozīmīgi nemainījās. saņemot vairākas sitagliptīna dienas devas, norādot, ka sitagliptīns nav CYP2C8 starpnieks vielmaiņa.
Varfarīns: vairākas sitagliptīna dienas devas nozīmīgi nemainīja farmakokinētiku, ko novērtēja, izmērot S (-) vai R (+) varfarīna enantiomēri vai farmakodinamika (vērtējot pēc protrombīna INR mērījumiem) vienā devā varfarīns. Tā kā S (-) varfarīnu galvenokārt metabolizē CYP2C9, šie dati arī apstiprina secinājumu, ka sitagliptīns nav CYP2C9 inhibitors.
Perorālie kontracepcijas līdzekļi: Vienlaicīga lietošana ar sitagliptīnu nemainīja noretindrona vai etinilestradiola līdzsvara stāvokļa farmakokinētiku.
Citu zāļu ietekme uz sitagliptīnu
Zemāk aprakstītie klīniskie dati liecina, ka sitagliptīns nav jutīgs pret vienlaikus lietotu zāļu klīniski nozīmīgu mijiedarbību.
Ciklosporīns: tika veikts pētījums, lai novērtētu ciklosporīna, spēcīga p-glikoproteīna inhibitora, ietekmi uz sitagliptīna farmakokinētiku. Vienlaicīga 100 mg perorāla sitagliptīna devas un vienreizēja 600 mg ciklosporīna perorāla lietošana palielināja AUC un Cmaks sitagliptīna attiecīgi par aptuveni 29% un 68%. Šīs nelielās sitagliptīna farmakokinētikas izmaiņas neuzskatīja par klīniski nozīmīgām. Arī sitagliptīna nieru klīrenss netika būtiski mainīts. Tāpēc nozīmīga mijiedarbība ar citiem p-glikoproteīna inhibitoriem nav gaidāma.
Metformīna hidrohlorīds
[Skatīt Mijiedarbība ar zālēm]
tops
Neklīniskā toksikoloģija
Kanceroģenēze, mutaģenēze, auglības pasliktināšanās
Janumets
Janumet kombinētajos produktos nav veikti pētījumi ar dzīvniekiem, lai novērtētu kanceroģenēzi, mutaģenēzi vai auglības traucējumus. Šie dati ir balstīti uz secinājumiem, kas veikti pētījumos ar sitagliptīnu un metformīnu atsevišķi.
Sitagliptīns
Divu gadu kancerogenitātes pētījums tika veikts ar žurku tēviņiem un mātītēm, kurām iekšķīgi lietoja sitagliptīna devas 50, 150 un 500 mg / kg dienā. Lietojot 500 mg / kg, bija palielināts kombinētās aknu adenomas / karcinomas biežums vīriešiem un sievietēm un aknu karcinomas sievietēm. Pamatojoties uz AUC salīdzinājumiem, šī deva rada iedarbību, kas aptuveni 60 reizes pārsniedz ekspozīciju cilvēkam, lietojot maksimālo ieteicamo pieaugušā cilvēka dienas devu (MRHD) 100 mg / dienā. Aknu audzēji netika novēroti, lietojot 150 mg / kg, aptuveni 20 reizes pārsniedzot ekspozīciju cilvēkam, lietojot MRHD. Divu gadu kancerogenitātes pētījums tika veikts ar pelēm tēviņiem un mātītēm, kurām iekšķīgi lietoja sitagliptīna devas 50, 125, 250 un 500 mg / kg dienā. Nevienā orgānā līdz 500 mg / kg audzēju sastopamība nepalielinājās, aptuveni 70 reizes pārsniedzot ekspozīciju cilvēkam MRHD. Ķīmiskā kāmja olnīcas (CHO) Ames baktēriju mutagenitātes testā sitagliptīns nebija mutagēns vai klastogēns ar metabolisma aktivāciju vai bez tās hromosomu aberācijas tests, in vitro citoģenētikas tests CHO, in vitro žurku hepatocītu DNS sārmainās eluācijas tests un in vivo mikrokodols pārbaude.
Žurku auglības pētījumos ar perorālo barības devu 125, 250 un 1000 mg / kg devu vīrieši tika ārstēti 4 nedēļas pirms pārošanās, pārošanās līdz plānotai pārtraukšanai (kopā apmēram 8 nedēļas), un mātītes tika ārstētas 2 nedēļas pirms pārošanās grūtniecības laikā 7. diena. Lietojot 125 mg / kg, netika novērota nelabvēlīga ietekme uz auglību (aptuveni 12 reizes pārsniedzot ekspozīciju cilvēkiem ar MRHD 100 mg / dienā, pamatojoties uz AUC salīdzinājumiem). Lietojot lielākas devas, novēroja ar nondose saistītu palielinātu rezorbciju sievietēm (aptuveni 25 un 100 reizes lielāka iedarbība uz cilvēku, izmantojot MRHD, pamatojoties uz AUC salīdzinājumu).
Metformīna hidrohlorīds
Ilgtermiņa kancerogenitātes pētījumi veikti ar žurkām (dozēšanas ilgums 104 nedēļas) un pelēm (dozēšanas ilgums 91 nedēļa) devās līdz un ieskaitot 900 mg / kg dienā un 1500 mg / kg dienā, attiecīgi. Šīs devas ir aptuveni četras reizes lielākas par maksimālo ieteicamo dienas devu 2000 mg, pamatojoties uz ķermeņa virsmas laukuma salīdzinājumiem. Pelēm tēviņiem un mātītēm netika atrasti pierādījumi par kancerogenitāti, lietojot metformīnu. Tāpat žurku tēviņiem, lietojot metformīnu, netika novērots audzēju veidošanās potenciāls. Tomēr žurku mātītēm, kuras ārstēja ar 900 mg / kg dienā, bija palielināts labdabīgu stromas dzemdes polipu biežums.
Šādos in vitro testos nebija pierādījumu par metformīna mutagēno potenciālu: Eimsa tests (S. typhimurium), gēnu mutāciju testu (peles limfomas šūnas) vai hromosomu aberāciju testu (cilvēka limfocīti). Arī in vivo peles mikrokodolu testa rezultāti bija negatīvi. Žurku tēviņu vai mātīšu auglību metformīns neietekmēja, ja tās lietoja devās līdz 600 mg / kg dienā, kas aptuveni trīs reizes pārsniedz maksimālo ieteicamo cilvēka dienas devu, pamatojoties uz ķermeņa virsmas laukumu salīdzinājumi.
tops
Klīniskie pētījumi
Vienlaicīga sitagliptīna un metformīna lietošana tika pētīta pacientiem ar 2. tipa cukura diabētu, kuru uzturu un fizisko aktivitāti nepietiekami kontrolēja, kā arī kombinācijā ar glimepirīdu.
Nav veikti klīniskās efektivitātes pētījumi ar Janumet; tomēr tika pierādīta Janumet bioekvivalence ar vienlaikus lietotajām sitagliptīna un metformīna hidrohlorīda tabletēm.
Sitagliptīna un metformīna vienlaicīga lietošana pacientiem ar 2. tipa cukura diabētu, kuru uzturs un fiziskā slodze nav pietiekami kontrolēta
Kopumā 24 nedēļu laikā piedalījās 1091 pacients ar 2. tipa cukura diabētu un nepietiekamu glikēmijas kontroli diētas un fiziskās aktivitātes laikā, randomizēts, dubultmaskēts, placebo kontrolēts faktoriālais pētījums, kas paredzēts, lai novērtētu sitagliptīna un metformīna efektivitāti līdzpārvalde. Pacientiem, kas lietoja antihiperglikēmisko līdzekli (N = 541), tika ievērots diētas, fizisko vingrinājumu un zāļu izdalīšanās periods līdz 12 nedēļām. Pēc mazgāšanas perioda pacienti ar nepietiekamu glikēmijas kontroli (A1C no 7,5% līdz 11%) tika randomizēti pēc 2 nedēļu ilgā vienreizējā akla placebo sākuma perioda pabeigšanas. Pacienti, kuri pētījuma sākumā nelieto antihiperglikēmiskos līdzekļus (N = 550) ar nepietiekamu glikēmijas kontroli (A1C 7,5% līdz 11%) nekavējoties iestājās 2 nedēļu vienreizējā aklā placebo ievada periodā un pēc tam tika randomizēts. Aptuveni vienāds skaits pacientu tika randomizēti, lai saņemtu placebo, 100 mg sitagliptīna vienreiz dienā, 500 mg vai 1000 mg metformīna divas reizes dienā vai 50 mg sitagliptīna divas reizes dienā kombinācijā ar 500 mg vai 1000 mg metformīna divreiz dienā katru dienu. Pacienti, kuri pētījuma laikā nespēja sasniegt noteiktus glikēmiskos mērķus, tika ārstēti ar glicurīda (glibenklamīda) glābšanu.
Vienlaicīga lietošana ar sitagliptīnu un metformīnu nodrošināja nozīmīgus uzlabojumus A1C, FPG un 2 stundu PPG, salīdzinot ar placebo, tikai ar metformīnu un tikai ar sitagliptīnu (3. tabula, 1. attēls). Vidēji A1C samazinājums no sākotnējā līmeņa parasti bija lielāks pacientiem ar augstākām sākotnējā A1C vērtībām. Pacientiem, kuriem pētījuma sākumā nebija antihiperglikēmisko līdzekļu, vidējais A1C samazinājums no sākotnējā līmeņa bija: sitagliptīns 100 mg vienu reizi dienā, -1,1%; metformīna 500 mg divas reizes dienā, -1,1%; metformīns 1000 mg divreiz, -1,2%; sitagliptīns 50 mg divreiz dienā ar metformīnu 500 mg divreiz, -1,6%; sitagliptīns 50 mg divreiz dienā ar metformīnu 1000 mg divreiz, -1,9%; un pacientiem, kuri saņēma placebo, -0,2%. Lipīdu iedarbība parasti bija neitrāla. Ķermeņa svara samazināšanās grupās, kurām sitagliptīnu lietoja kombinācijā ar metformīnu, bija līdzīga kā grupās, kuras saņēma tikai metformīnu vai placebo.
3. tabula: Glikēmiskie parametri galīgajā vizītē (24 nedēļu pētījums) attiecībā uz sitagliptīnu un metformīnu atsevišķi un kombinācijā pacientiem ar 2. tipa cukura diabētu, kuru uzturs un fiziskā slodze nav pietiekami kontrolēta *
Placebo |
Sitagliptīns 100 mg QD |
Metformīns 500 mg divreiz |
Metformīns 1000 mg divreiz |
Sitagliptīns 50 mg divreiz Metformīns 500 mg divreiz |
Sitagliptīns 50 mg divreiz Metformīns 1000 mg divreiz |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Sākumstāvoklis (vidējais) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Atšķirība no placebo (koriģētais vidējais†) (95% CI) |
-0.8c (-1.1, -0.6) |
-1.0c (-1.2, -0.8) |
-1.3c (-1.5, -1.1) |
-1.6c (-1.8, -1.3) |
-2.1c (-2.3, -1.8) |
|
| Pacienti (%), kuri sasniedz A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Pacientu, kas saņem glābšanas medikamentus | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dL) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Sākumstāvoklis (vidējais) | 196 | 201 | 205 | 197 | 204 | 197 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Atšķirība no placebo (koriģētais vidējais†) (95% CI) |
-23c (-33, -14) |
-33c (-43, -24) |
-35c (-45, -26) |
-53c (-62, -43) |
-70c (-79, -60) |
|
| 2 stundu PPG (mg / dL) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Sākumstāvoklis (vidējais) | 277 | 285 | 293 | 283 | 292 | 287 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Atšķirība no placebo (koriģētais vidējais†) (95% CI) |
-52c (-67, -37) |
-54c (-69, -39) |
-78c (-93, -63) |
-93c (-107, -78) |
-117c (-131, -102) |
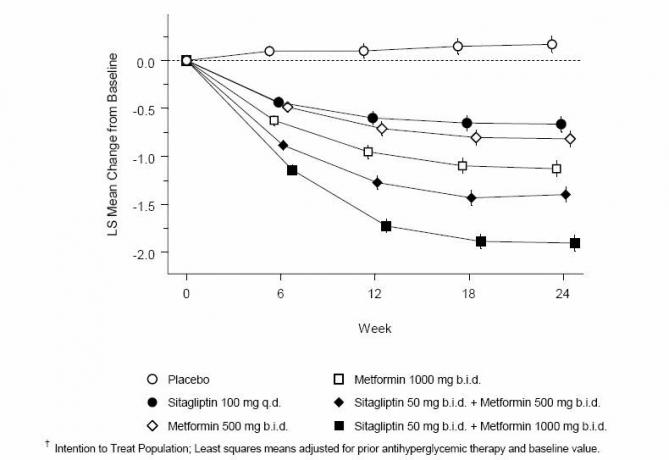
1. attēls: A1C vidējās izmaiņas no sākotnējā stāvokļa (%) 24 nedēļu laikā, lietojot vienatnē Sitagliptīnu un Metformīnu un kombinācijā pacientiem ar 2. tipa cukura diabētu, kuru nepietiekami kontrolē diēta un vingrinājumi
Turklāt šajā pētījumā piedalījās pacienti (N = 117) ar smagāku hiperglikēmiju (A1C> 11% vai asinis) glikoze> 280 mg / dL), kuri tika ārstēti ar divreiz dienā atklātu 50 mg sitagliptīna un metformīna 1000 mg. Šajā pacientu grupā vidējā sākotnējā A1C vērtība bija 11,2%, vidējā FPG bija 314 mg / dL un vidējā 2 stundu PPG bija 441 mg / dL. Pēc 24 nedēļām tika novērots vidējs pazeminājums no sākotnējā līmeņa par -2,9% A1C, -127 mg / dL FPG un -208 mg / dL 2 stundu PPG.
Sākotnējā kombinētā terapija vai kombinētās terapijas uzturēšana būtu jā individualizē, un veselības aprūpes sniedzējs to var atstāt pēc saviem ieskatiem.
Sitagliptīna papildterapija pacientiem ar 2. tipa cukura diabētu, kuru nepietiekami kontrolē tikai ar metformīnu
Kopumā 701 pacienti ar 2. tipa cukura diabētu piedalījās 24 nedēļu randomizētā, dubultmaskētā, placebo kontrolētā pētījumā, kura mērķis bija novērtēt sitagliptīna efektivitāti kombinācijā ar metformīnu. Pacienti, kuri jau lietoja metformīnu (N = 431) vismaz 1500 mg dienā, tika randomizēti pēc 2 nedēļu ilgā, vienreizējā akla placebo sākuma perioda beigām. Pacienti, kuri lieto metformīnu un citu antihiperglikēmisko līdzekli (N = 229), kā arī pacienti, kuri nelieto antihiperglikēmiskos līdzekļus (ārpus terapijas vismaz 8 nedēļas, N = 41) tika randomizēti pēc apmēram 10 nedēļu ilga sākuma perioda ar metformīnu (vismaz 1500 mg dienā) monoterapija. Pacienti tika randomizēti, pievienojot vai nu 100 mg sitagliptīna, vai placebo, lietojot vienu reizi dienā. Pacienti, kuri pētījumu laikā nespēja sasniegt noteiktus glikēmijas mērķus, tika ārstēti ar pioglitazona glābšanu.
Kombinācijā ar metformīnu sitagliptīns nodrošināja nozīmīgus uzlabojumus A1C, FPG un 2 stundu PPG, salīdzinot ar placebo ar metformīnu (4. tabula). Glābšanas glikēmijas terapija tika izmantota 5% pacientu, kuri tika ārstēti ar 100 mg sitagliptīna, un 14% pacientu, kuri tika ārstēti ar placebo. Abās ārstēšanas grupās tika novērots līdzīgs ķermeņa svara samazinājums.
4. tabula: Glikēmiskie parametri sitagliptīna pēdējā vizītē (24 nedēļu pētījums) papildterapijas kombinētajā terapijā ar metformīnu *
| Sitagliptīns 100 mg QD + Metformīns |
Placebo + Metformīns |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Sākumstāvoklis (vidējais) | 8.0 | 8.0 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -0.7 | -0.0 |
| Atšķirība no placebo + metformīna (koriģētais vidējais†) (95% CI) |
-0.7c (-0.8, -0.5) |
|
| Pacienti (%), kuri sasniedz A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dL) | N = 454 | N = 226 |
| Sākumstāvoklis (vidējais) | 170 | 174 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -17 | 9 |
| Atšķirība no placebo + metformīna (koriģētais vidējais†) (95% CI) |
-25c (-31, -20) |
|
| 2 stundu PPG (mg / dL) | N = 387 | N = 182 |
| Sākumstāvoklis (vidējais) | 275 | 272 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -62 | -11 |
| Atšķirība no placebo + metformīna (koriģētais vidējais†) (95% CI) |
-51c (-61, -41) |
Sitagliptīna papildterapija pacientiem ar 2. tipa cukura diabētu, kuru nepietiekami kontrolē, kombinējot metformīnu un glimepirīdu
Kopumā 441 pacients ar 2. tipa cukura diabētu piedalījās 24 nedēļu randomizētā, dubultmaskētā, placebo kontrolēts pētījums, kas paredzēts, lai novērtētu sitagliptīna efektivitāti kombinācijā ar glimepirīdu, ar vai bez metformīna. Pacienti uzsāka ārstēšanas periodu, lietojot tikai glimepirīdu (¥ ‰ 4 mg dienā) vai glimepirīdu kombinācijā ar metformīnu (¥ ¥ mg 1500 mg dienā). Pēc devas titrēšanas un stabilas devas ievadīšanas perioda līdz 16 nedēļām un 2 nedēļu placebo ievadīšanas perioda pacientiem ar nepietiekamu glikēmiskā kontrole (A1C no 7,5% līdz 10,5%) tika randomizēta, pievienojot vai nu 100 mg sitagliptīna, vai placebo, lietojot vienu reizi katru dienu. Pacienti, kuri pētījumu laikā nespēja sasniegt noteiktus glikēmijas mērķus, tika ārstēti ar pioglitazona glābšanu.
Pacientiem, kuri saņēma sitagliptīnu kopā ar metformīnu un glimepirīdu, bija nozīmīgi uzlabojumi A1C un FPG salīdzinājumā ar pacientiem, kuri saņēma placebo ar metformīnu un glimepirīdu (5. tabula) ar vidējo samazinājumu salīdzinājumā ar sākotnējo līmeni, salīdzinot ar placebo, A1C -0,9% un FPG -21 mg / dL. Glābšanas terapija tika izmantota 8% pacientu, kuri tika ārstēti ar 100 mg sitagliptīna, un 29% pacientu, kas ārstēti ar placebo. Pacientiem, kuri tika ārstēti ar papildus sitagliptīnu, vidējais ķermeņa svars palielinājās par 1,1 kg salīdzinājumā ar papildināms placebo (+0,4 kg salīdzinājumā ar -0,7 kg). Turklāt sitagliptīna papildinājums izraisīja paaugstinātu hipoglikēmijas līmeni salīdzinājumā ar placebo. [Skatīt Brīdinājumi un piesardzība; Nevēlamās reakcijas.]
5. tabula: Glikēmiskie parametri galīgajā vizītē (24 nedēļu pētījums) par sitagliptīnu kombinācijā ar metformīnu un glimepirīdu *
| 100 mg sitagliptīna + Metformīns un glimepirīds |
Placebo + Metformīns un glimepirīds |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Sākumstāvoklis (vidējais) | 8.3 | 8.3 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -0.6 | 0.3 |
| Atšķirība no placebo (koriģētais vidējais†) (95% CI) | -0.9c (-1.1, -0.7) |
|
| Pacienti (%), kuri sasniedz A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dL) | N = 115 | N = 109 |
| Sākumstāvoklis (vidējais) | 179 | 179 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -8 | 13 |
| Atšķirība no placebo (koriģētais vidējais†) (95% CI) | -21c (-32, -10) |
Sitagliptīna papildterapija vs. Glipizīda papildterapija pacientiem ar 2. tipa cukura diabētu, kuru nepietiekami kontrolē ar metformīnu
Sitagliptīna efektivitāte tika novērtēta 52 nedēļu ilgā dubultā aklā, glipizīda kontrolētā nenozīmīguma pakāpē pacientiem ar 2. tipa cukura diabētu. Pacienti, kuri netiek ārstēti, vai citi antihiperglikēmiskie līdzekļi, sāka ārstēšanās periodu līdz 12 nedēļām ar metformīna monoterapiju (dose ¥ ¥ 1500 mg dienā), kas ietvēra citu, izņemot metformīnu, zāļu izmešanu, ja piemērojams. Pēc ievades perioda tie, kuriem bija nepietiekama glikēmijas kontrole (A1C 6,5% līdz 10%), tika nejaušināti sadalīti 1: 1, pievienojot sitagliptīnu 100 mg vienu reizi dienā vai glipizīdu 52 nedēļas. Pacientiem, kuri saņēma glipizīdu, tika dota sākotnējā deva 5 mg / dienā, un pēc tam nākamo 18 nedēļu laikā to plānoti palielināja līdz maksimālajai devai 20 mg / dienā, kas nepieciešama, lai optimizētu glikēmijas kontroli. Pēc tam glipizīda deva bija jāsaglabā nemainīga, izņemot titrēšanas samazināšanu, lai novērstu hipoglikēmiju. Vidējā glipizīda deva pēc titrēšanas perioda bija 10 mg.
Pēc 52 nedēļām sitagliptīnam un glipizīdam bija līdzīgs vidējais A1C līmeņa samazinājums no sākotnējā līmeņa nodomu ārstēt analīzē (6. tabula). Šie rezultāti bija atbilstoši katra protokola analīzei (2. attēls). Secinājums par labu sitagliptīna nenovērtējumam par glipizīdu var būt tikai pacientiem ar sākotnējo stāvokli. A1C salīdzināms ar pētījumā iekļautajiem (vairāk nekā 70% pacientu sākotnējā A1C bija <8% un vairāk nekā 90% pacientu bija A1C <9%).
6. tabula: Glikēmiskie parametri 52 nedēļu pētījumā, kurā salīdzina sitagliptīnu ar glipizīdu kā papildterapiju pacientiem, kurus metformīns kontrolē nepietiekami (populācija ārstēšanai paredzētajam mērķim) *
| 100 mg sitagliptīna + Metformīns |
Glipizīds + Metformīns |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Sākumstāvoklis (vidējais) | 7.7 | 7.6 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -0.5 | -0.6 |
| FPG (mg / dL) | N = 583 | N = 568 |
| Sākumstāvoklis (vidējais) | 166 | 164 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | -8 | -8 |
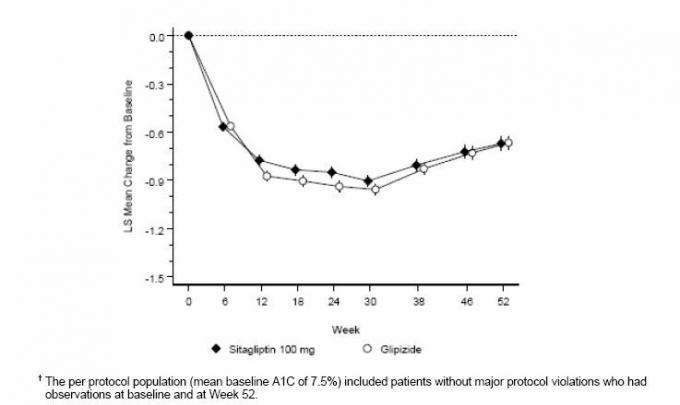
2. attēls: A1C vidējās izmaiņas no sākotnējā stāvokļa (%) 52 nedēļu laikā pētījumā, salīdzinot Sitagliptīnu ar Glipizīds kā papildterapija pacientiem, kurus nepietiekami kontrolē ar metformīnu (pēc katra protokola populācijas) â€
Hipoglikēmijas biežums sitagliptīna grupā (4,9%) bija ievērojami (p <0,001) zemāks nekā glipizīdu grupā (32,0%). Pacientiem, kuri tika ārstēti ar sitagliptīnu, novēroja ievērojamu ķermeņa masas vidējo samazinājumu salīdzinājumā ar sākotnējo līmeni, salīdzinot ar ievērojamu svara pieaugumu pacientiem, kuriem ievadīja glipizīdu (-1,5 kg pret. +1,1 kg).
tops
Kā piegādāts
Nr. 6747 - Janumet tabletes, 50 mg / 500 mg, ir gaiši rozā, kapsulas formas, apvalkotās tabletes ar iespiestu "575" vienā pusē. Tos piegādā šādi:
NDC 0006-0575-61 60 vienības lietošanas pudeles
NDC 0006-0575-62 180 vienības pudeles
NDC 0006-0575-52 vienas devas blistera iepakojumi pa 50
NDC 0006-0575-82 beztaras pudeles pa 1000.
Nr. 6749 - Janumet tabletes, 50 mg / 1000 mg, ir sarkanas, kapsulas formas, apvalkotas tabletes ar iespiestu "577" vienā pusē. Tos piegādā šādi:
NDC 0006-0577-61 60 vienības lietošanas pudeles
NDC 0006-0577-62 180 vienības pudeles
NDC 0006-0577-52 vienas devas blistera iepakojumi pa 50
NDC 0006-0577-82 beztaras pudeles pa 1000.
Uzglabāt 20-25 ° C (68-77 ° F) temperatūrā, pieļaujamas ekskursijas līdz 15-30 ° C (59-86 ° F).
tops
Informācija par pacientu konsultācijām
Instrukcijas
Pacienti jāinformē par Janumet iespējamo risku un ieguvumiem, kā arī par alternatīviem terapijas veidiem. Viņi arī jāinformē par to, cik svarīgi ir ievērot uztura norādījumus, regulāras fiziskās aktivitātes, periodiskas asinis glikozes līmeņa kontrole un A1C pārbaude, hipoglikēmijas un hiperglikēmijas atpazīšana un pārvaldība, kā arī diabēta novērtēšana komplikācijas. Stresa periodos, piemēram, drudzis, trauma, infekcija vai operācija, zāļu prasības var mainīties, un pacientiem jāiesaka nekavējoties meklēt medicīnisko palīdzību.
Pienskābes acidozes riski metformīna komponenta, tā simptomu un apstākļu dēļ, kas predisponē tā attīstību, kā minēts Brīdinājumi un piesardzība, jāpaskaidro pacientiem. Pacientiem jāiesaka nekavējoties pārtraukt Janumet lietošanu un nekavējoties paziņot ārstam, ja neizskaidrojama hiperventilācija, mialģija, savārgums, neparasta miegainība, reibonis, lēna vai neregulāra sirdsdarbība, aukstuma sajūta (īpaši ekstremitātēs) vai citi nespecifiski simptomi rodas. Kuņģa-zarnu trakta simptomi ir raksturīgi bieži, uzsākot ārstēšanu ar metformīnu, un tie var parādīties Janumet terapijas sākumā; tomēr pacientiem jākonsultējas ar ārstu, ja viņiem rodas neizskaidrojami simptomi. Lai gan kuņģa un zarnu trakta simptomi, kas rodas pēc stabilizācijas, maz ticams, ka tie būs saistīti ar zālēm, šādi jānovērtē simptomu rašanās, lai noteiktu, vai tā cēlonis var būt laktacidoze vai citas nopietnas pazīmes slimība.
Janumet lietošanas laikā pacienti jāinformē par pārmērīgu akūta vai hroniska alkohola lietošanu.
Pacienti jāinformē par to, cik svarīgi regulāri ārstēt nieru darbību un hematoloģiskos parametrus, ārstējot ar Janumet.
Pacienti jāinformē, ka sitagliptīna, kas ir viens no Janumet komponentiem, lietošanas laikā pēc laišanas tirgū tika ziņots par alerģiskām reakcijām. Ja rodas alerģisku reakciju simptomi (ieskaitot izsitumus, nātreni un sejas, lūpu, mēles un rīkles pietūkumu, kas var rasties) izraisīt apgrūtinātu elpošanu vai rīšanu), pacientiem jāpārtrauc lietot Janumet un jāmeklē medicīniska palīdzība nekavējoties.
Ārstiem jāuzdod saviem pacientiem pirms Janumet terapijas izlasīt pacienta zāļu lietošanas instrukciju un katru reizi, kad tiek atjaunota recepte, lasīt atkārtoti. Pacientiem jāinformē ārsts vai farmaceits, ja viņiem rodas kādi neparasti simptomi vai ja kāds no zināmajiem simptomiem saglabājas vai pastiprinās.
Laboratorijas testi
Reakcija uz visu diabēta terapiju jāuzrauga, periodiski mērot glikozes līmeni asinīs un A1C līmeni ar mērķi samazināt šo līmeni normālā diapazonā. A1C ir īpaši noderīgs, lai novērtētu ilgstošu glikēmijas kontroli.
Sākotnēja un periodiska hematoloģisko parametru (piemēram, hemoglobīna / hematokrīta un sarkano asiņu) kontrole šūnu indeksi) un nieru darbība (kreatinīna līmenis serumā) jāveic vismaz katru gadu. Kaut arī ar metformīna terapiju reti ir novērota megaloblastiska anēmija, ja ir aizdomas par to, B12 vitamīna deficīts jāizslēdz.
Izplata:
MERCK & CO., INC., Whitehouse Station, NJ 08889, ASV
9794108
ASV patents Nr.: 6 699 871
1 MERCK & CO., Inc. reģistrēta preču zīme, Whitehouse Station, Ņūdžersija 08889 ASV
2Marke & Co., Inc. preču zīme, Whitehouse Station, Ņūdžersija 08889 ASV
3GLUCOPHAGE® ir Merck Sante S.A.S reģistrēta preču zīme, kas ir Merck KGaA asociētais uzņēmums Darmštatē, Vācijā.
Licencēts uzņēmumam Bristol-Myers Squibb.
AUTORTIESĪBAS © 2007, 2008 MERCK & CO., Inc.
Visas tiesības aizsargātas
FDA apstiprināta pacienta marķēšana
Informācija par pacientu
Janumet® (JAN-jūs-met)
(sitagliptīns / metformīna HCl)
Tabletes
Pirms sākat lietot un katru reizi, kad saņemat papildinājumu, izlasiet informāciju par pacientu, kas nāk kopā ar Janumet1. Var būt jauna informācija. Šī instrukcija neaizstāj sarunu ar ārstu par jūsu medicīnisko stāvokli vai ārstēšanu.
Kāda ir vissvarīgākā informācija, kas man būtu jāzina par Janumet?
Metformīna hidrohlorīds, kas ir viena no Janumet sastāvdaļām, var izraisīt retu, bet nopietnu blakusparādību, ko sauc par pienskābozi (pienskābes uzkrāšanos asinīs), kas var izraisīt nāvi. Pienskābes acidoze ir ārkārtas medicīniska situācija, un tā jāārstē slimnīcā.
Pārtrauciet lietot Janumet un nekavējoties zvaniet savam ārstam, ja rodas kāds no šiem laktacidozes simptomiem:
- Jūs jūtaties ļoti vājš un noguris.
- Jums ir neparastas (ne normālas) muskuļu sāpes.
- Jums ir apgrūtināta elpošana.
- Jums ir neizskaidrojamas kuņģa vai zarnu problēmas ar sliktu dūšu un vemšanu vai caureju.
- Jūs jūtat aukstu, it īpaši rokās un kājās.
- Jums ir reibonis vai reibonis.
- Jums ir lēna vai neregulāra sirdsdarbība.
Jums ir lielākas iespējas iegūt pienskābo acidozi, ja:
- ir nieru darbības traucējumi.
- ir aknu darbības traucējumi.
- ir sastrēguma sirds mazspēja, kurai nepieciešama ārstēšana ar zālēm.
- dzert daudz alkohola (ļoti bieži vai īstermiņa "iedzeršana").
- dehidrēts (zaudēt lielu daudzumu ķermeņa šķidrumu). Tas var notikt, ja jūs slimojat ar drudzi, vemšanu vai caureju. Dehidratācija var notikt arī tad, ja daudz svīst ar aktivitāti vai fiziskām aktivitātēm un nedzer pietiekami daudz šķidruma.
- veikt noteiktus rentgenstaru testus ar injicējamām krāsvielām vai kontrastvielām.
- ir operācija.
- Jums ir sirdslēkme, smaga infekcija vai insults.
- esat 80 gadus vecs vai vecāks, un jūsu nieru darbība nav pārbaudīta.
Kas ir Janumet?
Janumet tabletes satur divas recepšu zāles - sitagliptīnu (JANUVIA ™ 2) un metformīnu. Janumet var lietot kopā ar uzturu un fiziskām aktivitātēm, lai pazeminātu cukura līmeni asinīs pieaugušiem pacientiem ar 2. tipa cukura diabētu. Ārsts noteiks, vai Janumet ir piemērots jums, un noteiks labāko veidu, kā sākt un turpināt diabēta ārstēšanu.
Janumets:
- palīdz uzlabot insulīna līmeni pēc ēšanas.
- palīdz organismam labāk reaģēt uz insulīnu, ko tas rada dabiski.
- samazina ķermeņa ražotā cukura daudzumu.
- maz ticams, ka tas izraisīs zemu cukura līmeni asinīs (hipoglikēmiju), ja pats par sevi to lieto augsta cukura līmeņa asinīs ārstēšanai.
Janumet nav pētīts bērniem līdz 18 gadu vecumam.
Janumet nav pētīts ar insulīnu - zālēm, kas izraisa zemu cukura līmeni asinīs.
Kam nevajadzētu lietot Janumet?
Nelietojiet Janumet, ja:
- ir 1. tipa cukura diabēts.
- ir noteiktas nieru problēmas.
- Jums ir stāvokļi, ko sauc par metabolisko acidozi vai diabētisko ketoacidozi (paaugstināts ketonu līmenis asinīs vai urīnā).
- ir bijusi alerģiska reakcija pret Janumet vai sitagliptīnu (JANUVIA), kas ir viena no Janumet sastāvdaļām.
- gatavojas saņemt krāsvielu vai kontrastvielu injekciju rentgena procedūrai, Janumet vajadzēs uz neilgu laiku pārtraukt. Konsultējieties ar ārstu par to, kad pārtraukt Janumet lietošanu un kad sākt no jauna. Sk. "Kāda ir vissvarīgākā informācija, kas man būtu jāzina par Janumet?"
Kas man jāsaka ārstam pirms ārstēšanas ar Janumet un tās laikā?
Janumet var nebūt jums piemērots. Pastāstiet savam ārstam par visiem jūsu veselības stāvokļiem, ieskaitot:
- ir nieru darbības traucējumi.
- ir aknu darbības traucējumi.
- ir bijusi alerģiska reakcija pret Janumet vai sitagliptīnu (JANUVIA), kas ir viena no Janumet sastāvdaļām.
- ir sirds problēmas, tai skaitā sastrēguma sirds mazspēja.
- ir vecāki par 80 gadiem. Pacientiem, vecākiem par 80 gadiem, nevajadzētu lietot Janumet, ja nav pārbaudīta viņu nieru darbība un tā ir normāla.
- daudz lietojiet alkoholu (visu laiku vai īstermiņa "iedzeršana").
- esat grūtniece vai plānojat grūtniecību. Nav zināms, vai Janumet kaitēs jūsu vēl nedzimušajam bērnam. Ja esat stāvoklī, konsultējieties ar ārstu par labāko veidu, kā kontrolēt cukura līmeni asinīs grūtniecības laikā. Ja jūs lietojat Janumet grūtniecības laikā, konsultējieties ar ārstu par to, kā jūs varat atrasties Janumet reģistrā. Bezmaksas tālruņa numurs grūtniecības reģistrā ir 1-800-986-8999.
- barojat bērnu ar krūti vai plānojat to darīt. Nav zināms, vai Janumet izdalīsies mātes pienā. Konsultējieties ar ārstu par labāko veidu, kā barot bērnu, ja lietojat Janumet.
Pastāstiet ārstam par visām zālēm, kuras lietojat, ieskaitot recepšu un bezrecepšu zāles, vitamīnus un augu piedevas. Janumet var ietekmēt citu zāļu iedarbību, un dažas zāles var ietekmēt Janumet darbību.
Ziniet lietotās zāles. Saglabājiet savu zāļu sarakstu un parādiet to savam ārstam un farmaceitam, kad saņemat jaunas zāles. Pirms jebkuru jaunu zāļu lietošanas konsultējieties ar ārstu.
Kā man vajadzētu lietot Janumet?
- Ārsts jums pateiks, cik daudz Janumet tablešu jālieto un cik bieži tās jālieto. Lietojiet Janumet tieši tā, kā ārsts Jums norādījis.
- Ārstam, iespējams, vajadzēs palielināt devu, lai kontrolētu cukura līmeni asinīs.
- Ārsts var izrakstīt Janumet kopā ar sulfonilurīnvielu (citām zālēm cukura līmeņa pazemināšanai asinīs). Skatīt "Kādas ir Janumet iespējamās blakusparādības?" informācijai par paaugstinātu zema cukura līmeņa asinīs risku.
- Lietojiet Janumet ēšanas laikā, lai mazinātu kuņģa darbības traucējumus.
- Turpiniet lietot Janumet tik ilgi, cik ārsts jums norādījis.
- Ja esat lietojis pārāk daudz Janumet, nekavējoties zvaniet savam ārstam vai saindēšanās kontroles centram.
- Ja esat izlaidis devu, lietojiet to kopā ar ēdienu, tiklīdz atceraties. Ja neatceraties, kamēr nav pienācis laiks nākamajai devai, izlaidiet aizmirsto devu un dodieties atpakaļ uz parasto grafiku. Nelietojiet divas Janumet devas vienlaikus.
- Jums var būt nepieciešams uz neilgu laiku pārtraukt Janumet lietošanu. Zvaniet savam ārstam, lai saņemtu norādījumus, ja:
- ir dehidrēti (ir zaudējuši pārāk daudz ķermeņa šķidruma). Dehidratācija var rasties, ja slimojat ar smagu vemšanu, caureju vai drudzi vai ja dzerat daudz mazāk šķidruma nekā parasti.
- plānojat veikt operāciju.
- gatavojamies saņemt krāsvielas vai kontrastvielas injekciju rentgena procedūrai.
Sk. "Kāda ir vissvarīgākā informācija, kas man būtu jāzina par Janumet?" un "Kam nevajadzētu Janumet lietot?"
- Kad jūsu ķermenis ir pakļauts dažu veidu stresam, piemēram, drudzim, traumām (piemēram, autoavārijai), infekcijai vai operācijai, nepieciešamais diabēta zāļu daudzums var mainīties. Nekavējoties pastāstiet ārstam, ja rodas kāds no šiem stāvokļiem, un ievērojiet ārsta norādījumus.
- Pārraugiet cukura līmeni asinīs, kā ārsts jums norādījis.
- Janumet lietošanas laikā ievērojiet noteikto diētu un vingrojumu programmu.
- Konsultējieties ar ārstu par to, kā novērst, atpazīt un pārvaldīt zemu cukura līmeni asinīs (hipoglikēmiju), paaugstinātu cukura līmeni asinīs (hiperglikēmiju) un diabēta komplikācijas.
- Ārsts kontrolēs jūsu diabētu ar regulārām asins analīzēm, ieskaitot cukura līmeni asinīs un hemoglobīna A1C līmeni.
- Ārsts veiks asins analīzes, lai pārbaudītu nieru darbību pirms ārstēšanas ar Janumet un tās laikā.
Kādas ir Janumet iespējamās blakusparādības?
Janumet var izraisīt nopietnas blakusparādības. Sk. "Kāda ir vissvarīgākā informācija, kas man būtu jāzina par Janumet?"
Biežas blakusparādības, lietojot Janumet, ir šādas:
- aizlikts vai iesnas un iekaisis kakls
- augšējo elpceļu infekcija
- caureja
- slikta dūša un vemšana
- gāze, diskomforts kuņģī, gremošanas traucējumi
- vājums
- galvassāpes
Janumet lietošana ēdienreizēs var palīdzēt samazināt metformīna biežas blakusparādības kuņģī, kas parasti rodas ārstēšanas sākumā. Ja jums ir neparasti vai negaidīti kuņģa darbības traucējumi, konsultējieties ar ārstu. Kuņģa problēmas, kas rodas vēlāk ārstēšanas laikā, var liecināt par kaut ko nopietnāku.
Dažas diabēta zāles, piemēram, sulfonilurīnvielas atvasinājumi un meglitinīdi, var izraisīt zemu cukura līmeni asinīs (hipoglikēmiju). Ja Janumet lieto kopā ar šīm zālēm, jums var būt pārāk zems cukura līmenis asinīs. Ārsts var izrakstīt mazākas sulfonilurīnvielas vai meglitinīda zāļu devas. Pastāstiet savam ārstam, ja rodas problēmas ar zemu cukura līmeni asinīs.
Ir ziņots par šādām papildu blakusparādībām, lietojot kopā ar Janumet vai sitagliptīnu:
- Janumet vai sitagliptīns, kas ir viena no Janumet zālēm, var izraisīt nopietnas alerģiskas reakcijas. Nopietnas alerģiskas reakcijas simptomi var būt izsitumi, nātrene un sejas, lūpu, mēles un rīkles pietūkums, apgrūtināta elpošana vai rīšana. Ja Jums ir alerģiska reakcija, pārtrauciet lietot Janumet un nekavējoties zvaniet savam ārstam. Ārsts var izrakstīt zāles alerģiskas reakcijas ārstēšanai un citas zāles diabēta ārstēšanai.
- Paaugstināts aknu enzīmu līmenis.
- Aizkuņģa dziedzera iekaisums.
Tās nav visas iespējamās Janumet blakusparādības. Lai iegūtu papildinformāciju, jautājiet savam ārstam.
Pastāstiet savam ārstam, ja jums ir kādas blakusparādības, kas jūs uztrauc, ir neparastas vai nepazūd.
Kā man vajadzētu uzglabāt Janumet?
Uzglabājiet Janumet istabas temperatūrā, kas ir no 20 līdz 25 ° C (68-77 ° F).
Janumet un visas zāles glabājiet bērniem nepieejamā vietā.
Vispārīga informācija par Janumet lietošanu
Dažreiz zāles tiek izrakstītas tādiem stāvokļiem, kas nav minēti pacienta informācijas bukletos. Nelietojiet Janumet stāvoklim, kuram tas nebija noteikts. Nedodiet Janumet citiem cilvēkiem, pat ja viņiem ir tādi paši simptomi kā jums. Tas var viņiem kaitēt.
Šajā brošūrā ir apkopota vissvarīgākā informācija par Janumet. Ja vēlaties uzzināt vairāk informācijas, konsultējieties ar ārstu. Jūs varat lūgt savam ārstam vai farmaceitam informāciju par Janumet, kas paredzēta veselības speciālistiem. Lai iegūtu vairāk informācijas, zvaniet pa tālruni 1-800-622-4477.
Kādas ir Janumet sastāvdaļas?
Aktīvās sastāvdaļas: sitagliptīns un metformīna hidrohlorīds.
Neaktīvas sastāvdaļas: mikrokristāliskā celuloze, polivinilpirolidons, nātrija laurilsulfāts un nātrija stearilfumarāts. Tabletes plēves apvalks satur šādas neaktīvas sastāvdaļas: polivinilspirtu, polietilēnglikolu, talku, titāna dioksīdu, sarkano dzelzs oksīdu un melno dzelzs oksīdu.
Kas ir 2. tipa cukura diabēts?
2. tipa cukura diabēts ir stāvoklis, kad jūsu ķermenis neizgatavo pietiekami daudz insulīna, un jūsu ķermeņa ražotais insulīns nedarbojas tik labi, kā vajadzētu. Jūsu ķermenis var arī radīt pārāk daudz cukura. Kad tas notiek, asinīs uzkrājas cukurs (glikoze). Tas var izraisīt nopietnas medicīniskas problēmas.
Galvenais diabēta ārstēšanas mērķis ir pazemināt cukura līmeni asinīs līdz normālam līmenim. Cukura līmeņa pazemināšana un kontrole asinīs var palīdzēt novērst vai aizkavēt diabēta komplikācijas, piemēram, sirds problēmas, nieru darbības traucējumus, aklumu un amputāciju.
Paaugstinātu glikozes līmeni asinīs var samazināt diētas un fiziskās aktivitātes, kā arī, ja nepieciešams, noteiktas zāles.
Izdots 2009. gada martā
Izplata:
MERCK & CO., INC., Whitehouse Station, NJ 08889, ASV
Pēdējoreiz atjaunināts: 03/09
Janumet, Sitagliptīns un metformīna hidrohlorīds, informācija par pacientu (vienkāršā angļu valodā)
Sīkāka informācija par diabēta pazīmēm, simptomiem, cēloņiem, ārstēšanu
Informācija šajā monogrāfijā nav paredzēta visiem iespējamiem lietojumiem, norādījumiem, piesardzības pasākumiem, zāļu mijiedarbību vai nelabvēlīgu iedarbību. Šī informācija ir vispārināta un nav paredzēta kā īpaša medicīniska konsultācija. Ja jums ir jautājumi par lietotajām zālēm vai vēlaties uzzināt vairāk informācijas, sazinieties ar ārstu, farmaceitu vai medmāsu.
atpakaļ uz: Pārlūkot visus medikamentus diabēta ārstēšanai

