Actos 2. tipa diabēta ārstēšanai
Zīmols: Actos
Vispārīgais nosaukums: Pioglitazona hidrohlorīds
Saturs:
Apraksts
Farmakoloģija
Indikācijas un lietošana
Kontrindikācijas
Brīdinājumi
Piesardzības pasākumi
Nevēlamās reakcijas
Pārdozēšana
Devas un ievadīšana
Kā piegādāts
Actos, pioglitazone hcl, informācija par pacientiem (vienkāršā angļu valodā)
BRĪDINĀJUMS
- Tiazolidīndioni, ieskaitot Actos, dažiem pacientiem izraisa vai pastiprina sastrēguma sirds mazspēju (skatīt BRĪDINĀJUMI). Pēc Actos lietošanas uzsākšanas un pēc devas palielināšanas uzmanīgi novērojiet pacientus, lai redzētu sirds mazspējas pazīmes un simptomus (ieskaitot pārmērīgu, strauju svara pieaugumu, aizdusu un / vai tūsku). Ja šīs pazīmes un simptomi attīstās, sirds mazspēja jāpārvalda saskaņā ar pašreizējiem aprūpes standartiem. Turklāt jāapsver Actos lietošanas pārtraukšana vai samazināšana.
- Actos nav ieteicams pacientiem ar simptomātisku sirds mazspēju. Actos sākšana pacientiem ar konstatētu NYHA III vai IV klases sirds mazspēju ir kontrindicēta (skatīt KONTRINDIKĀCIJAS un BRĪDINĀJUMI).
Apraksts
Actos (pioglitazona hidrohlorīds) ir perorāls antidiabēta līdzeklis, kas galvenokārt darbojas, samazinot rezistenci pret insulīnu. Actos lieto 2. tipa cukura diabēta (pazīstams arī kā no insulīnneatkarīga cukura diabēta (NIDDM) vai pieauguša cilvēka diabēta) ārstēšanai. Farmakoloģiskie pētījumi liecina, ka Actos uzlabo jutību pret insulīnu muskuļos un taukaudos un kavē aknu glikoneoģenēzi. Actos uzlabo glikēmijas kontroli, vienlaikus samazinot cirkulējošā insulīna līmeni.
Pioglitazons [(±) -5 - [[4- [2- (5-etil-2-piridinil) etoksi] fenil] metil] -2,4-] tiazolidīndiona monohidrohlorīds pieder pie atšķirīga ķīmiskā klase, un tai ir atšķirīga farmakoloģiskā iedarbība nekā sulfonilurīnvielas atvasinājumiem, metformīnam vai ± ± glikozidāzei inhibitori. Molekulā ir viens asimetrisks ogleklis, un savienojums tiek sintezēts un izmantots kā racēmiskais maisījums. Pioglitazona divi enantiomēri savstarpēji pārvēršas in vivo. Starp abiem enantiomēriem farmakoloģiskajā darbībā neatšķīrās. Strukturālā formula ir šāda:
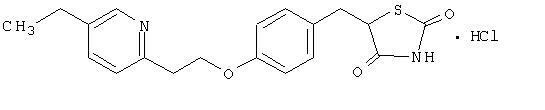
Pioglitazona hidrohlorīds ir balts kristālisks pulveris bez smaržas, kura molekulārā formula ir C19H20N2O3S-HCl un molekulmasa 392,90 daltoni. Tas šķīst N, N-dimetilformamīdā, nedaudz šķīst bezūdens etanolā, ļoti nedaudz šķīst acetonā un acetonitrilā, praktiski nešķīst ūdenī un nešķīst ēterī.
Actos ir pieejams tablešu veidā iekšķīgai lietošanai, kas satur 15 mg, 30 mg vai 45 mg pioglitazona (kā bāzi), kas sagatavots ar šādas palīgvielas: lAktozes monohidrāts NF, hidroksipropilcelulozes NF, karboksimetilcelulozes kalcija NF un magnija stearāts NF.
tops
Klīniskā farmakoloģija
Darbības mehānisms
Actos ir tiazolidīndiona pretdiabēta līdzeklis, kura darbības mehānisms ir atkarīgs no insulīna klātbūtnes. Actos samazina rezistenci pret insulīnu perifērijā un aknās, kā rezultātā palielinās no insulīna atkarīgās glikozes izdalīšanās un samazinās glikozes daudzums aknās. Atšķirībā no sulfonilurīnvielas atvasinājumiem pioglitazons nav insulīna sekrēcijas līdzeklis. Pioglitazons ir spēcīgs peroksisomu proliferatoru aktivēta gamma (PPARγ) agonists. PPAR receptori ir atrodami audos, kas ir svarīgi insulīna darbībai, piemēram, taukaudos, skeleta muskuļos un aknās. PPARγ kodolreceptoru aktivizēšana modulē vairāku uz insulīnu reaģējošu gēnu transkripciju, kas iesaistīti glikozes un lipīdu metabolisma kontrolē.
Dzīvnieku diabēta modeļos pioglitazons samazina hiperglikēmiju, hiperinsulinēmiju un hipertrigliceridēmiju, kas raksturīga insulīnrezistentiem stāvokļiem, piemēram, 2. tipa diabētam. Pioglitazona radītās metabolisma izmaiņas palielina no insulīna atkarīgo audu reakciju un tiek novērotas daudzos dzīvnieku rezistences modeļos.
Tā kā pioglitazons pastiprina cirkulējošā insulīna iedarbību (samazinot insulīna rezistenci), tas nepazemina glikozes līmeni asinīs dzīvnieku modeļos, kuriem trūkst endogēna insulīna.
Farmakokinētika un zāļu metabolisms
Kopējā pioglitazona (pioglitazona un aktīvo metabolītu) koncentrācija serumā saglabājas paaugstināta 24 stundas pēc devas ievadīšanas vienu reizi dienā. Pioglitazona un kopējā pioglitazona līdzsvara stāvokļa koncentrācija serumā tiek sasniegta 7 dienu laikā. Līdzsvara stāvoklī divi no pioglitazona farmakoloģiski aktīvajiem metabolītiem - III (M-III) un IV (M-IV) - metabolīti sasniedz seruma koncentrāciju, kas ir vienāda vai lielāka par pioglitazonu. Gan veseliem brīvprātīgajiem, gan pacientiem ar 2. tipa cukura diabētu pioglitazons veido aptuveni 30% līdz 50% no maksimālā pioglitazona koncentrācija serumā un no 20% līdz 25% no kopējās platības zem seruma koncentrācijas un laika līknes (AUC).
Maksimālā koncentrācija serumā (Cmaks), AUC un minimālo koncentrāciju serumā (Cmin) gan pioglitazonam, gan kopējam pioglitazonam palielinās proporcionāli, lietojot devas 15 mg un 30 mg dienā. Lietojot 60 mg dienā, pioglitazons un kopējais pioglitazons palielinās nedaudz mazāk nekā proporcionāli.
Uzsūkšanās: Pēc perorālas lietošanas tukšā dūšā pioglitazonu serumā vispirms var izmērīt 30 minūšu laikā, maksimālo koncentrāciju novērojot 2 stundu laikā. Pārtika nedaudz aizkavē laiku, lai sasniegtu maksimālo koncentrāciju serumā līdz 3 līdz 4 stundām, bet nemaina absorbcijas apmēru.
Izkliede: Vidējais pioglitazona šķietamais izkliedes tilpums (Vd / F) pēc vienas devas ievadīšanas ir 0,63 ± 0,41 (vidējais ± SD) L / kg ķermeņa svara.
Pioglitazons cilvēka serumā plaši saistās ar olbaltumvielām (> 99%), galvenokārt ar seruma albumīnu. Pioglitazons saistās arī ar citiem seruma proteīniem, bet ar zemāku afinitāti. Metabolīti M-III un M-IV ir plaši saistīti (> 98%) ar seruma albumīnu.
Metabolisms: Pioglitazons tiek plaši metabolizēts hidroksilēšanas un oksidācijas ceļā; metabolīti daļēji pārvēršas arī par glikuronīda vai sulfāta konjugātiem. Metabolīti M-II un M-IV (pioglitazona hidroksi atvasinājumi) un M-III (pioglitazona keto atvasinājumi) ir farmakoloģiski aktīvi 2. tipa diabēta dzīvnieku modeļos. Papildus pioglitazonam M-III un M-IV ir galvenās ar narkotikām saistītās sugas, kas pēc vairākkārtējas lietošanas atrodamas cilvēka serumā. Līdzsvara stāvoklī pioglitazons gan veseliem brīvprātīgajiem, gan pacientiem ar 2. tipa cukura diabētu satur apmēram 30% līdz 50% no kopējās maksimālās koncentrācijas serumā un 20% līdz 25% no kopējās koncentrācijas serumā kopējais AUC.
In vitro dati liecina, ka pioglitazona metabolismā ir iesaistītas vairākas CYP izoformas. Iesaistītās citohroma P450 izoformas ir CYP2C8 un mazākā mērā CYP3A4 ar papildu devumu no daudzām citām izoformām, ieskaitot galvenokārt ekstrahepatisko CYP1A1. In vivo veikti pioglitazona kombinācijā ar P450 inhibitoriem un substrātiem (sk Mijiedarbība ar zālēm). Urīna 6Ÿ-hidroksikortizola / kortizola attiecības, kas izmērītas pacientiem, kuri ārstēti ar Actos, parādīja, ka pioglitazons nav spēcīgs CYP3A4 enzīmu induktors.
Izdalīšanās un eliminācija: Pēc iekšķīgas lietošanas apmēram 15% līdz 30% no pioglitazona devas tiek izdalīti urīnā. Pioglitazons caur nierēm izdalās niecīgi, un zāles galvenokārt izdalās metabolītu un to konjugātu veidā. Tiek pieņemts, ka lielākā daļa perorālās devas izdalās žulī nemainītā veidā vai metabolītu veidā un izdalās ar fekālijām.
Vidējais pioglitazona un kopējā pioglitazona eliminācijas pusperiods serumā ir attiecīgi no 3 līdz 7 stundām un no 16 līdz 24 stundām. Pioglitazonam ir šķietamais klīrenss, CL / F, kas aprēķināts no 5 līdz 7 L / stundā.
Īpašās populācijas
Nieru mazspēja: Pioglitazona, M-III un M-IV eliminācijas pusperiods pacientiem ar mērenu paliek nemainīgs (kreatinīna klīrenss no 30 līdz 60 ml / min) līdz smagiem (kreatinīna klīrenss <30 ml / min) nieru darbības traucējumiem, salīdzinot ar normālu priekšmeti. Pacientiem ar nieru darbības traucējumiem devas pielāgošana nav ieteicama (skatīt DEVAS UN ADMINISTRĀCIJA).
Aknu nepietiekamība: Salīdzinot ar parasto kontroli, pacientiem ar aknu darbības traucējumiem (Child / Pugh B / C pakāpe) ir aptuvenā pioglitazona un kopējās pioglitazona vidējās maksimālās koncentrācijas samazināšanās par 45%, bet vidējā AUC nemainās vērtības.
Actos terapiju nedrīkst uzsākt, ja pacientam ir aktīvas aknu slimības klīniskās pazīmes vai seruma transamināžu (ALAT) līmenis pārsniedz 2,5 reizes virs normas augšējās robežas (skatīt PIESARDZĪBAS PASĀKUMI, Ietekme uz aknām).
Gados vecāki cilvēki: veseliem vecāka gadagājuma cilvēkiem pioglitazona un kopējā pioglitazona maksimālā koncentrācija serumā nav ievērojami atšķiras, bet AUC vērtības ir nedaudz augstākas, un gala eliminācijas pusperioda vērtības ir nedaudz garākas nekā jaunāki priekšmeti. Šīs izmaiņas nebija tik lielas, ka tās varētu uzskatīt par klīniski nozīmīgām.
Pediatrija: farmakokinētiskie dati par bērnu stāvokli nav pieejami.
Dzimums: vidējais Cmaks un AUC vērtības sievietēm tika palielinātas par 20% līdz 60%. Monoterapijas veidā un kombinācijā ar sulfonilurīnvielu, metformīnu vai insulīnu Actos uzlaboja glikēmijas kontroli gan vīriešiem, gan sievietēm. Kontrolētos klīniskajos pētījumos hemoglobīns A1c (HbA1c) samazinājums salīdzinājumā ar sākotnējo līmeni sievietēm bija lielāks nekā vīriešiem (vidējā HbA atšķirība)1c 0.5%). Tā kā glikēmijas līmeņa kontrolei terapija ir individuāla katram pacientam, devas pielāgošana nav ieteicama, ņemot vērā tikai dzimumu.
Etniskā piederība: farmakokinētiskie dati par dažādām etniskajām grupām nav pieejami.
Narkotiku un zāļu mijiedarbība
Veseliem brīvprātīgajiem, vienlaikus lietojot Actos 45 mg vienu reizi dienā, tika pētītas šādas zāles. Zemāk uzskaitīti rezultāti:
Perorālie kontracepcijas līdzekļi: Actos (45 mg vienu reizi dienā) un perorālo kontracepcijas līdzekļu (1 mg norethindrone plus) vienlaikus lietošana 0,035 mg etinilestradiola vienu reizi dienā 21 dienas laikā izraisīja etinilestradiola AUC samazināšanos par 11% un 11–14% (0–24 h). un Cmaks attiecīgi. Netika novērotas nozīmīgas noretindrona AUC (0–24h) un C izmaiņasmaks. Ņemot vērā etinilestradiola farmakokinētikas lielo mainīgumu, šī atklājuma klīniskā nozīme nav zināma.
Feksofenadīna HCl: Vienlaicīga Actos lietošana 7 dienas ar 60 mg feksofenadīna, lietojot perorāli divas reizes dienā, būtiski neietekmēja pioglitazona farmakokinētiku. Actos būtiski neietekmēja feksofenadīna farmakokinētiku.
Glipizīds: Vienlaicīga Actos un 5 mg glipizīda lietošana iekšķīgi vienu reizi dienā 7 dienas, nemainīja glipizīda līdzsvara stāvokļa farmakokinētiku.
Digoksīns: Vienlaicīga Actos lietošana ar 0,25 mg digoksīna, lietojot iekšķīgi vienu reizi dienā 7 dienas, nemainīja digoksīna līdzsvara stāvokļa farmakokinētiku.
Varfarīns: Actos vienlaicīga lietošana 7 dienas ar varfarīnu nemainīja varfarīna līdzsvara stāvokļa farmakokinētiku. Actos nav klīniski nozīmīgas ietekmes uz protrombīna laiku, ja tos ievada pacientiem, kuri saņem hroniskas varfarīna terapiju.
Metformīns: Vienreizēja metformīna devas (1000 mg) un Actos vienlaicīga lietošana pēc Actos 7 dienām nemainīja metformīna vienas devas farmakokinētiku.
Midazolāms: Actos ievadīšana 15 dienas un pēc tam viena 7,5 mg midazolāma sīrupa deva izraisīja midazolāma C samazināšanos par 26%maks un AUC.
Ranitidīna HCl: Actos 7 dienas ilgi lietojot kopā ar ranitidīnu iekšķīgi divas reizes dienā 4 vai 7 dienas, nozīmīga ietekme uz pioglitazona farmakokinētiku nebija. Actos neuzrādīja būtisku ietekmi uz ranitidīna farmakokinētiku.
Nifedipīna ER: Vienlaicīga Actos lietošana 7 dienas ar 30 mg nifedipīna ER, lietojot iekšķīgi vienu reizi dienā 4 dienas līdz brīvprātīgo vīriešu un sieviešu vidējā nemainītā nifedipīna vidējā kvadrāta (90% TI) vērtības bija 0,83 (0,73 - 0,95) Cmaks un 0,88 (0,80 - 0,96) par AUC. Ņemot vērā nifedipīna farmakokinētikas lielo mainīgumu, šī atklājuma klīniskā nozīme nav zināma.
Ketokonazols: Actos 7 dienas lieto vienlaikus ar 200 mg ketokonazola divreiz katru dienu nemainītā pioglitazona vidējās kvadrātiskās (90% TI) vērtības bija 1,14 (1,06 - 1,23). Cmaks, 1,34 (1,26 - 1,41) AUC un 1,87 (1,71 - 2,04) Cmin.
Atorvastatīna kalcijs: Actos 7 dienas lieto kopā ar 80 mg atorvastatīna kalcija (LIPITOR®) vienu reizi dienā nemainītā pioglitazona vidējās kvadrātiskās (90% TI) vērtības bija 0,69 (0,57 - 0,85). Cmaks, 0,76 (0,65 - 0,88) AUC un 0,96 (0,87 - 1,05) Cmin. Neizmainītam atorvastatīna mazākajam kvadrātam vidējais (90% TI) C bija 0,77 (0,66 - 0,90).maks, 0,86 (0,78 - 0,94) AUC un 0,92 (0,82 - 1,02) Cmin.
Teofilīns: Actos 7 dienas ilgi lietojot kopā ar teofilīnu 400 mg divas reizes dienā, abu zāļu farmakokinētika nemainījās.
Citohroms P450: sk PIESARDZĪBAS PASĀKUMI
Gemfibrozils: vienlaicīga CYP2C8 inhibitora gemfibrozila (pa 600 mg divas reizes dienā) un pioglitazona (perorāli 30 mg) lietošana 10 veseliem brīvprātīgajiem, kuri iepriekš tika ārstēti 2 dienas pirms gemfibrozila (iekšķīgi lietojot 600 mg divas reizes dienā), pioglitazona iedarbība (AUC0-24) bija 226% no pioglitazona ekspozīcijas, ja gemfibrozila nebija. (skat PIESARDZĪBAS PASĀKUMI).
Rifampīns: vienlaicīga rifampīna (perorāli 600 mg vienreiz dienā), CYP2C8 induktora, lietošana kopā ar pioglitazonu (perorāli 30 mg) 10 veseliem brīvprātīgajiem, kas 5 dienas iepriekš tika ārstēti ar rifampīnu (perorāli 600 mg vienreiz dienā), pioglitazona AUC samazinājās par 54% (skatīt PIESARDZĪBAS PASĀKUMI).
Farmakodinamika un klīniskā iedarbība
Klīniskie pētījumi pierāda, ka Actos uzlabo jutību pret insulīnu pacientiem, kas izturīgi pret insulīnu. Actos uzlabo šūnu reakciju uz insulīnu, palielina no insulīna atkarīgo glikozes izdalīšanos, uzlabo aknu jutīgumu pret insulīnu un uzlabo disfunkcionālu glikozes homeostāzi. Pacientiem ar 2. tipa cukura diabētu Actos radītā samazinātā insulīna rezistence rada zemāku glikozes koncentrāciju plazmā, zemāku insulīna līmeni plazmā un zemāku HbA līmeni.1c vērtības. Balstoties uz atklātā pagarinātā pētījuma rezultātiem, šķiet, ka Actos glikozes līmeni pazeminošā iedarbība saglabājas vismaz vienu gadu. Kontrolētos klīniskajos pētījumos Actos kombinācijā ar sulfonilurīnvielu, metformīnu vai insulīnu bija papildu iedarbība uz glikēmijas kontroli.
Actos klīniskajos pētījumos tika iekļauti pacienti ar lipīdu līmeņa traucējumiem. Kopumā pacientiem, kuri tika ārstēti ar Actos, bija novērots vidējais triglicerīdu līmeņa pazemināšanās, vidējais ABL holesterīna līmeņa paaugstināšanās un nebija konsekventu ZBL un kopējā holesterīna līmeņa vidējo izmaiņu.
26 nedēļu placebo kontrolētā, devu diapazona pētījumā vidējais triglicerīdu līmenis samazinājās 15 mg, 30 mg un 45 mg Actos devu grupās, salīdzinot ar vidējo placebo grupas palielināšanos. Pacientiem, kuri tika ārstēti ar Actos, vidējais ABL līmenis palielinājās vairāk nekā pacientiem, kuri saņēma placebo. Pacientiem, kuri tika ārstēti ar Actos, nebija konsekventu ZBL un kopējā holesterīna atšķirību salīdzinājumā ar placebo (1. tabula).
1. tabula. Lipīdi 26 nedēļu placebo kontrolētā monoterapijas devas noteikšanas pētījumā
| Placebo | Actos 15 mg Vienreiz Katru dienu |
Actos 30 mg Vienreiz Katru dienu |
Actos 45 mg Vienreiz Katru dienu |
|
| Triglicerīdi (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Sākumstāvoklis (vidējais) | 262.8 | 283.8 | 261.1 | 259.7 |
| Procentuālās izmaiņas salīdzinājumā ar sākotnējo līmeni (vidējais) | 4.8% | -9.0% | -9.6% | -9.3% |
| ABL holesterīns (mg / dL) | N = 79 | N = 79 | N = 83 | N = 77 |
| Sākumstāvoklis (vidējais) | 41.7 | 40.4 | 40.8 | 40.7 |
| Procentuālās izmaiņas salīdzinājumā ar sākotnējo līmeni (vidējais) | 8.1% | 14.1% | 12.2% | 19.1% |
| ZBL holesterīns (mg / dL) | N = 65 | N = 63 | N = 74 | N = 62 |
| Sākumstāvoklis (vidējais) | 138.8 | 131.9 | 135.6 | 126.8 |
| Procentuālās izmaiņas salīdzinājumā ar sākotnējo līmeni (vidējais) | 4.8% | 7.2% | 5.2% | 6.0% |
| Kopējais holesterīna līmenis (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Sākumstāvoklis (vidējais) | 224.6 | 220.0 | 222.7 | 213.7 |
| Procentuālās izmaiņas salīdzinājumā ar sākotnējo līmeni (vidējais) | 4.4% | 4.6% | 3.3% | 6.4% |
Divos citos monoterapijas pētījumos (24 nedēļas un 16 nedēļas) un kombinētās terapijas pētījumos ar sulfonilurīnvielu (24 nedēļas un 16 nedēļas) un metformīna (24 nedēļas un 16 nedēļas) rezultāti kopumā bija atbilstoši datiem virs. Placebo kontrolētos pētījumos pacientiem, kas ārstēti ar Actos, ar placebo koriģētās vidējās izmaiņas no sākotnējā līmeņa samazinājās par 5% līdz 26% triglicerīdu gadījumā un palielinājās par 6% līdz 13% ABL. Līdzīgs rezultātu modelis tika novērots Actos 24 nedēļu kombinētās terapijas pētījumos ar sulfonilurīnvielu vai metformīnu.
Kombinētās terapijas pētījumā ar insulīnu (16 nedēļas) samazinājās arī placebo koriģētās vidējās procentuālās izmaiņas procentos no sākotnējā līmeņa triglicerīdu vērtībā pacientiem, kuri tika ārstēti ar Actos. 15 mg devu grupā tika novērotas placebo koriģētas vidējās ZBL holesterīna līmeņa izmaiņas 7% no sākotnējā līmeņa. Tika novēroti līdzīgi rezultāti, kas iepriekš tika atzīmēti attiecībā uz ABL un kopējo holesterīnu. Līdzīgs rezultātu modelis tika novērots 24 nedēļu kombinētās terapijas pētījumā, kurā piedalījās Actos ar insulīnu.
Klīniskie pētījumi
Monoterapija
Lai novērtētu Actos izmantošanu monoterapijā pacientiem ar 2. tipa cukura diabētu, ASV tika veikti trīs randomizēti, dubultmaskēti, placebo kontrolēti pētījumi ar ilgumu no 16 līdz 26 nedēļām. Šajos pētījumos tika pārbaudīti Actos ar devām līdz 45 mg vai placebo vienu reizi dienā 865 pacientiem.
26 nedēļu ilgā, devu diapazona pētījumā 408 pacienti ar 2. tipa cukura diabētu tika randomizēti, lai saņemtu 7,5 mg, 15 mg, 30 mg vai 45 mg Actos vai placebo vienu reizi dienā. Ārstēšana ar jebkuru iepriekšējo antidiabēta līdzekli tika pārtraukta 8 nedēļas pirms dubultmaskētā perioda. Ārstēšana ar 15 mg, 30 mg un 45 mg Actos izraisīja statistiski nozīmīgus HbA1c un tukšā dūšā glikozes līmeņa (FPG) uzlabojumus galarezultātā, salīdzinot ar placebo (1. attēls, 2. tabula).
1. attēlā parādīts FPG un HbA1c izmaiņu laika grafiks visai pētījuma populācijai šajā 26 nedēļu pētījumā.
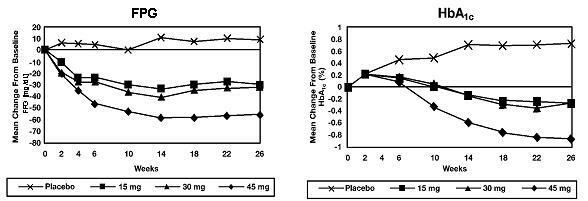
2. tabulā parādīts HbA1c un FPG vērtības visai pētījuma populācijai.
2. tabula Glikēmiskie parametri 26 nedēļu placebo kontrolētā devas diapazona pētījumā
| Placebo | Actos 15 mg Vienreiz Katru dienu |
Actos 30 mg Vienreiz Katru dienu |
Actos 45 mg Vienreiz Katru dienu |
|
| KOPĀ IEDZĪVOTĀJI | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Sākumstāvoklis (vidējais) | 10.4 | 10.2 | 10.2 | 10.3 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Atšķirība no placebo (koriģētais vidējais+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dL) | N = 79 | N = 79 | N = 84 | N = 77 |
| Sākumstāvoklis (vidējais) | 268 | 267 | 269 | 276 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais+) | 9 | -30 | -32 | -56 |
| Atšķirība no placebo (koriģētais vidējais+) | -39* | -41* | -65* | |
|
+ Pielāgots sākotnējam, apvienotajam centram un apvienotajam centram pēc ārstēšanas mijiedarbības * p â ‰ ¤ 0,050 vs. placebo |
Pētījuma populācijā bija pacienti, kuri iepriekš nebija ārstēti ar antidiabēta līdzekļiem (iepriekš nebija ārstēti; 31%) un pacienti, kuri pētījuma uzņemšanas laikā saņēma antidiabēta zāles (iepriekš ārstēti; 69%). Dati par iepriekš neārstētām un iepriekš ārstētām pacientu apakšgrupām ir parādīti 3. tabulā. Visi pacienti pirms dubultmaskētās ārstēšanas sākās 8 nedēļu ilgā izdalīšanās / iesākšanās periodā. Šis sākuma periods bija saistīts ar nelielām HbA izmaiņām1c un FPG vērtības no skrīninga līdz sākotnējam stāvoklim pacientiem, kas iepriekš nebija ārstēti; tomēr iepriekš ārstētai grupai izdalīšanās no iepriekšējiem antidiabēta līdzekļiem izraisīja glikēmijas kontroles pasliktināšanos un HbA palielināšanos1c un FPG. Lai gan lielākajai daļai pacientu, kas ārstēti iepriekš, HbA līmenis samazinājās no sākotnējā līmeņa1c un FPG ar Actos, daudzos gadījumos vērtības līdz pētījuma beigām neatgriezās skrīninga līmenī. Pētījuma plāns neļāva novērtēt pacientus, kuri tieši pārņēma Actos no cita antidiabēta līdzekļa.
3. tabula Glikēmiskie parametri 26 nedēļu placebo kontrolētā devas diapazona pētījumā
| Placebo | Actos 15 mg Vienreiz Katru dienu |
Actos 30 mg Vienreiz Katru dienu |
Actos 45 mg Vienreiz Katru dienu |
|
| Nav terapijas HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Skrīnings (vidējais) | 9.3 | 10.0 | 9.5 | 9.8 |
| Sākumstāvoklis (vidējais) | 9.0 | 9.9 | 9.3 | 10.0 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Atšķirība no placebo (koriģētais vidējais *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dL) | N = 25 | N = 26 | N = 26 | N = 21 |
| Skrīnings (vidējais) | 223 | 245 | 239 | 239 |
| Sākumstāvoklis (vidējais) | 229 | 251 | 225 | 235 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais *) | 16 | -37 | -41 | -64 |
| Atšķirība no placebo (koriģētais vidējais *) | -52 | -56 | -80 | |
| Iepriekš apstrādāts HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Skrīnings (vidējais) | 9.3 | 9.0 | 9.1 | 9.0 |
| Sākumstāvoklis (vidējais) | 10.9 | 10.4 | 10.4 | 10.6 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Atšķirība no placebo (koriģētais vidējais *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dL) | N = 54 | N = 53 | N = 58 | N = 56 |
| Skrīnings (vidējais) | 222 | 209 | 230 | 215 |
| Sākumstāvoklis (vidējais) | 285 | 275 | 286 | 292 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais *) | 4 | -32 | -27 | -55 |
| Atšķirība no placebo (koriģētais vidējais *) | -36 | -31 | -59 | |
| * Pielāgots bāzes līmenim un apvienotajam centram |
24 nedēļu placebo kontrolētā pētījumā 260 pacienti ar 2. tipa cukura diabētu tika nejaušināti iedalīti vienā no divām piespiedu titrēšanas Actos terapijas grupām vai imitētās titrēšanas placebo grupas. Ārstēšana ar jebkuru iepriekšējo antidiabēta līdzekli tika pārtraukta 6 nedēļas pirms dubultmaskētā perioda. Vienā Actos terapijas grupā pacienti saņēma sākotnējo devu 7,5 mg vienu reizi dienā. Pēc četrām nedēļām devu palielināja līdz 15 mg vienreiz dienā un pēc vēl četrām nedēļām devu palielināja līdz 30 mg vienreiz dienā atlikušajā pētījuma laikā (16 nedēļas). Otrajā Actos terapijas grupā pacienti saņēma sākotnējo devu 15 mg vienu reizi dienā, un līdzīgā veidā to titrēja līdz 30 mg vienreiz dienā un 45 mg vienreiz dienā. Aprakstītā ārstēšana ar Actos izraisīja statistiski nozīmīgus HbA uzlabojumus1c un FPG parametrā salīdzinājumā ar placebo (4. tabula).
4. tabula Glikēmiskie parametri 24 nedēļu placebo kontrolētā piespiedu titrēšanas pētījumā
| Placebo | Actos 30 mg+ Vienreiz dienā |
Actos 45 mg+ Vienreiz dienā |
|
| Kopējais iedzīvotāju skaits HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Sākumstāvoklis (vidējais) | 10.8 | 10.3 | 10.8 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais++) | 0.9 | -0.6 | -0.6 |
| Atšķirība no placebo (koriģētais vidējais++) | -1.5* | -1.5* | |
| FPG (mg / dL) | N = 78 | N = 82 | N = 85 |
| Sākumstāvoklis (vidējais) | 279 | 268 | 281 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais++) | 18 | -44 | -50 |
| Atšķirība no placebo (koriģētais vidējais++) | -62* | -68* | |
|
+ Pēdējā deva piespiedu titrēšanā ++ Pielāgots sākotnējam, apvienotajam centram un apvienotajam centram pēc ārstēšanas mijiedarbības * p â ‰ ¤ 0,050 vs. placebo |
Pacientiem, kuri iepriekš nebija ārstēti ar antidiabēta līdzekļiem (24%), vidējie HbA rādītāji skrīninga laikā bija 10,1%.1c un 238 mg / dL FPG. Sākotnējā vidējā HbA1c bija 10,2% un vidējais FPG bija 243 mg / dL. Salīdzinot ar placebo, ārstēšana ar Actos, titrējot līdz galīgajai devai 30 mg un 45 mg, samazināja vidējo HbA no sākotnējā līmeņa.1c attiecīgi 2,3% un 2,6%, un vidējā FPG attiecīgi 63 mg / dL un 95 mg / dL. Pacientiem, kuri iepriekš bija ārstēti ar antidiabēta līdzekļiem (76%), šīs zāles tika pārtrauktas skrīninga laikā. Skrīninga vidējās vērtības HbA bija 9,4%1c un 216 mg / dL FPG. Sākotnējā vidējā HbA1c bija 10,7% un vidējais FPG bija 290 mg / dL. Salīdzinot ar placebo, ārstēšana ar Actos, titrējot līdz galīgajai devai 30 mg un 45 mg, samazināja vidējo HbA no sākotnējā līmeņa.1c attiecīgi 1,3% un 1,4% un vidējā FPG attiecīgi 55 mg / dL un 60 mg / dL. Daudziem iepriekš ārstētiem pacientiem HbA1c un FPG līdz pētījuma beigām nebija atgriezušies skrīninga līmenī.
16 nedēļu ilgā pētījumā 197 pacienti ar 2. tipa cukura diabētu tika randomizēti ārstēšanai ar 30 mg Actos vai placebo vienu reizi dienā. Ārstēšana ar jebkuru iepriekšējo antidiabēta līdzekli tika pārtraukta 6 nedēļas pirms dubultmaskētā perioda. Ārstēšana ar 30 mg Actos izraisīja statistiski nozīmīgus HbA uzlabojumus1c un FPG parametrā salīdzinājumā ar placebo (5. tabula).
5. tabula Glikēmiskie parametri 16 nedēļu placebo kontrolētā pētījumā
| Placebo | Actos 30 mg Vienreiz dienā |
|
| Kopējais iedzīvotāju skaits HbA1c (%) |
N = 93 | N = 100 |
| Sākumstāvoklis (vidējais) | 10.3 | 10.5 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais+) | 0.8 | -0.6 |
| Atšķirība no placebo (koriģētais vidējais+) | -1.4* | |
| FPG (mg / dL) | N = 91 | N = 99 |
| Sākumstāvoklis (vidējais) | 270 | 273 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais+) | 8 | -50 |
| Atšķirība no placebo (koriģētais vidējais+) | -58* | |
|
+ Pielāgots sākotnējam, apvienotajam centram un apvienotajam centram pēc ārstēšanas mijiedarbības * p â ‰ ¤ 0,050 vs. placebo |
Pacientiem, kuri iepriekš nebija ārstēti ar antidiabēta līdzekļiem (40%), skrīninga vidējās vērtības bija 10,3% HbA1c un 240 mg / dL FPG. Sākotnējā vidējā HbA1c bija 10,4% un vidējais FPG bija 254 mg / dL. Salīdzinot ar placebo, ārstēšana ar Actos 30 mg izraisīja vidējā HbA samazināšanos no sākotnējā līmeņa1c 1,0% un vidējā FPG 62 mg / dL. Pacientiem, kuri iepriekš bija ārstēti ar antidiabēta līdzekļiem (60%), šīs zāles tika pārtrauktas skrīninga laikā. Skrīninga vidējās vērtības HbA bija 9,4%1c un 216 mg / dL FPG. Sākotnējā vidējā HbA1c bija 10,6% un vidējais FPG bija 287 mg / dL. Salīdzinot ar placebo, ārstēšana ar Actos 30 mg izraisīja vidējā HbA samazināšanos no sākotnējā līmeņa1c 1,3% un vidējā FPG 46 mg / dL. Daudziem iepriekš ārstētiem pacientiem HbA1c un FPG līdz pētījuma beigām nebija atgriezušies skrīninga līmenī.
Kombinētā terapija
Trīs 16 nedēļu, randomizēti, dubultmaskēti, placebo kontrolēti klīniskie pētījumi un trīs 24 nedēļu, randomizēti, dubultmaskēti, ar devu kontrolēti tika veikti klīniskie pētījumi, lai novērtētu Actos ietekmi uz glikēmijas kontroli pacientiem ar 2. tipa cukura diabētu, kuri bija nepietiekami kontrolēts (HbA1c â ‰ ¥ 8%), neskatoties uz pašreizējo terapiju ar sulfonilurīnvielu, metformīnu vai insulīnu. Iepriekšēja diabēta ārstēšana varēja būt monoterapija vai kombinēta terapija.
Actos Plus sulfonilurīnvielas atvasinājumu pētījumi
Tika veikti divi klīniskie pētījumi ar Actos kombinācijā ar sulfonilurīnvielu. Abos pētījumos piedalījās pacienti ar 2. tipa cukura diabētu, lietojot sulfonilurīnvielu atsevišķi vai kombinācijā ar citu pretdiabēta līdzekli. Visi citi pretdiabēta līdzekļi tika atcelti pirms pētījuma ārstēšanas uzsākšanas. Pirmajā pētījumā 560 pacienti tika randomizēti, lai saņemtu 16 mg vai 30 mg Actos vai placebo vienu reizi dienā 16 nedēļu laikā papildus pašreizējam sulfonilurīnvielas atvasinājumu režīmam. Salīdzinot ar placebo 16. nedēļā, Actos pievienošana sulfonilurīnvielai ievērojami samazināja vidējo HbA1c par 0,9% un 1,3%, un vidējā FPG attiecīgi par 39 mg / dL un 58 mg / dL attiecīgi 15 mg un 30 mg devām.
Otrajā pētījumā 702 pacienti tika nejaušināti iedalīti 30 un 45 mg Actos vienreiz dienā 24 nedēļu laikā papildus pašreizējai sulfonilurīnvielas atvasinājumu shēmai. HbA vidējais samazinājums no sākotnējā līmeņa 24. nedēļā1c bija attiecīgi 1,55% un 1,67% 30 mg un 45 mg devām. Vidējais FPG samazinājums no sākotnējā līmeņa bija 51,5 mg / dL un 56,1 mg / dL.
Actos kombinācijā ar sulfonilurīnvielas atvasinājumu terapeitiskais efekts tika novērots pacientiem neatkarīgi no tā, vai pacienti saņēma mazas, vidējas vai lielas sulfonilurīnvielas atvasinājumu devas.
Actos Plus metformīna pētījumi
Tika veikti divi klīniski pētījumi ar Actos kombinācijā ar metformīnu. Abos pētījumos iesaistīja pacientus ar 2. tipa cukura diabētu, lietojot metformīnu atsevišķi vai kombinācijā ar citu antidiabēta līdzekli. Visi citi pretdiabēta līdzekļi tika atcelti pirms pētījuma ārstēšanas uzsākšanas. Pirmajā pētījumā 328 pacienti tika randomizēti un saņēma 16 mg nedēļas katru dienu 30 mg Actos vai placebo papildus pašreizējam metformīna režīmam. Salīdzinot ar placebo 16. nedēļā, Actos pievienošana metformīnam ievērojami samazināja vidējo HbA1c par 0,8% un samazināja vidējo FPG par 38 mg / dL.
Otrajā pētījumā 827 pacienti tika randomizēti, lai saņemtu vai nu 30 mg, vai 45 mg Actos vienreiz dienā 24 nedēļas, papildus pašreizējam metformīna režīmam. HbA vidējais samazinājums no sākotnējā līmeņa 24. nedēļā1c bija attiecīgi 0,80% un 1,01% 30 mg un 45 mg devām. Vidējais FPG samazinājums no sākotnējā līmeņa bija 38,2 mg / dL un 50,7 mg / dL.
Actos kombinācijā ar metformīnu terapeitiskais efekts tika novērots pacientiem neatkarīgi no tā, vai pacienti saņēma zemākas vai lielākas metformīna devas.
Actos Plus insulīna pētījumi
Tika veikti divi klīniskie pētījumi ar Actos kombinācijā ar insulīnu. Abos pētījumos piedalījās pacienti ar 2. tipa cukura diabētu, lietojot insulīnu atsevišķi vai kombinācijā ar citu antidiabēta līdzekli. Visi citi pretdiabēta līdzekļi tika atcelti pirms pētījuma ārstēšanas uzsākšanas. Pirmajā pētījumā 566 pacienti, kuri saņēma vidējo 60,5 vienību insulīna dienā, tika randomizēti papildus insulīnam saņem 15 mg vai 30 mg Actos vai placebo vienreiz dienā 16 nedēļas režīms. Salīdzinot ar placebo 16. nedēļā, Actos pievienošana insulīnam ievērojami samazināja abus HbA1c attiecīgi par 0,7% un 1,0% un FPG par 35 mg / dL un 49 mg / dL attiecīgi 15 mg un 30 mg devām.
Otrajā pētījumā 690 pacienti, kuri saņēma vidējo 60,0 vienību dienā insulīna, saņēma vai nu 30 mg, vai 45 mg Actos vienreiz dienā 24 nedēļas, papildus pašreizējai insulīna shēmai. HbA vidējais samazinājums no sākotnējā līmeņa 24. nedēļā1c bija attiecīgi 1,17% un 1,46% 30 mg un 45 mg devām. Vidējais FPG samazinājums no sākotnējā līmeņa bija 31,9 mg / dL un 45,8 mg / dL. Uzlabota glikēmijas līmeņa kontrole bija saistīta ar vidēju nepieciešamības samazināt insulīna devu, salīdzinot ar sākotnējo līmeni, attiecīgi par 6,0% un 9,4% dienā, lietojot attiecīgi 30 mg un 45 mg devas.
Actos kombinācijā ar insulīnu terapeitiskā iedarbība tika novērota pacientiem neatkarīgi no tā, vai pacienti saņēma zemākas vai lielākas insulīna devas.
tops
Indikācijas un lietošana
Actos ir indicēts kā diētas un fiziskās aktivitātes papildinājums, lai uzlabotu glikēmijas kontroli pieaugušajiem ar 2. tipa cukura diabētu.
tops
Kontrindikācijas
Actos sākšana pacientiem ar iedibinātu Ņujorkas Sirds asociācijas (NYHA) III vai IV klases sirds mazspēju ir kontrindicēta (skatīt BOXED BRĪDINĀJUMS).
Actos ir kontrindicēts pacientiem ar zināmu paaugstinātu jutību pret šo produktu vai kādu tā sastāvdaļu.
tops
Brīdinājumi
Sirds mazspēja un citas sirdsdarbības
Actos, tāpat kā citi tiazolidīndioni, var izraisīt šķidruma aizturi, ja tos lieto atsevišķi vai kombinācijā ar citiem pretdiabēta līdzekļiem, ieskaitot insulīnu. Šķidruma aizture var izraisīt vai saasināt sirds mazspēju. Pacienti jānovēro, vai nav sirds mazspējas pazīmju un simptomu. Ja šīs pazīmes un simptomi attīstās, sirds mazspēja jāpārvalda saskaņā ar pašreizējiem aprūpes standartiem. Turklāt jāapsver Actos pārtraukšana vai devas samazināšana (sk BOXED BRĪDINĀJUMS). Iepriekš apstiprināšanas klīnisko pētījumu laikā pacienti ar NYHA III un IV klases sirds stāvokli netika pētīti, un Actos nav ieteicams šiem pacientiem (skatīt BOXED BRĪDINĀJUMS un KONTRINDIKĀCIJAS).
Vienā 16 nedēļu ilgā ASV dubultaklā, placebo kontrolētā klīniskajā pētījumā, kurā piedalījās 566 pacienti ar 2. tipu diabēts, Actos devās 15 mg un 30 mg kombinācijā ar insulīnu tika salīdzinātas ar insulīna terapiju vienatnē. Šajā pētījumā piedalījās šādi pacienti ar ilgstošu diabētu un augstu iepriekšējo medicīnisko stāvokļu izplatību: arteriāla hipertensija (57,2%), perifēra neiropātija (22,6%), koronārā sirds slimība (19,6%), retinopātija (13,1%), miokarda infarkts (8,8%), asinsvadu slimības (6,4%), stenokardija (4,4%), insults un / vai pārejoša išēmiska lēkme (4,1%) un sastrēgumi sirds mazspēja (2,3%).
Šajā pētījumā divi no 191 pacienta, kas saņēma 15 mg Actos plus insulīna (1,1%), un divi no 188 pacientiem, kuri saņēma 30 mg Actos plus insulīns (1,1%) attīstīja sastrēguma sirds mazspēju, salīdzinot ar nevienu no 187 pacientiem, kuri ārstējās tikai ar insulīnu. Visiem četriem šiem pacientiem iepriekš bija kardiovaskulāru saslimšanu vēsture, ieskaitot koronāro artēriju slimību, iepriekšējās CABG procedūras un miokarda infarktu. 24 nedēļu ilgā, devas kontrolētā pētījumā, kurā Actos tika lietots vienlaikus ar insulīnu, 0,3% pacientu (1/345) ar 30 mg un 0,9% (3/345) pacientu, kuri lietoja 45 mg, CHF ziņoja par nopietnu nevēlamu notikumu. .
Šo pētījumu datu analīze nekonstatēja īpašus faktorus, kas paredz palielinātu sastrēguma sirds mazspējas risku, lietojot kombinētu terapiju ar insulīnu.
2. tipa diabēta un sastrēguma sirds mazspējas gadījumā (sistoliskā disfunkcija)
Tika veikts 24 nedēļu ilgs pēcreģistrācijas drošības pētījums, lai Actos (n = 262) salīdzinātu ar glicerīdu (n = 256) nekontrolētiem diabēta pacientiem (vidējais HbA1c 8,8% sākumā) ar NYHA II un III klases sirds mazspēju un izsviedes frakciju mazāku par 40% (vidējais EF 30% sākotnējā līmenī). Pētījuma laikā par sastrēguma sirds mazspējas hospitalizāciju naktī uz nakti ziņoja 9,9% gadījumu pacienti, kuri lietoja Actos, salīdzinot ar 4,7% pacientu, kas lietoja glicerīdu, ar ārstēšanas atšķirību, kas novērota no 6 pacientiem nedēļas. Šis ar Actos saistītais nevēlamais notikums bija izteiktāks pacientiem, kuri sākotnēji lietoja insulīnu, un pacientiem, kas vecāki par 64 gadiem. Netika novērota atšķirība kardiovaskulārajā mirstībā starp ārstēšanas grupām.
Actos jāuzsāk ar mazāko apstiprināto devu, ja tas ir parakstīts pacientiem ar 2. tipa cukura diabētu un sistolisko sirds mazspēju (NYHA II klase). Ja nepieciešama turpmāka devas palielināšana, deva pakāpeniski jāpalielina tikai pēc vairākām reizēm mēnešu ārstēšanas laikā ar rūpīgu svara pieauguma, tūskas vai CHF pazīmju un simptomu novērošanu saasināšanās.
Perspektīvais Pioglitazona klīniskais pētījums makrovaskulāros notikumos (PROaktīvs)
PROaktīvā terapijā 5238 pacienti ar 2. tipa cukura diabētu un makrovaskulāru slimību anamnēzē tika ārstēti ar Actos (n = 2605), ar titru devu palielināja līdz 45 mg vienu reizi dienā vai ar placebo (n = 2633) (sk. NEVĒLAMĀS REAKCIJAS). Pacientu skaits, kuriem bija nopietnas sirds mazspējas gadījumi, bija lielāks pacientiem, kuri tika ārstēti ar Actos (5,7%, n = 149), nekā pacientiem, kuri tika ārstēti ar placebo (4,1%, n = 108). Nāves biežums pēc ziņojuma par nopietnu sirds mazspēju bija 1,5% (n = 40) pacientiem, kuri tika ārstēti ar Actos, un 1,4% (n = 37), lietojot placebo. Pacientiem, kuri sākotnēji tika ārstēti ar insulīnu saturošu shēmu, smagas sirds mazspējas biežums bija 6,3% (n = 54/864) ar Actos un 5,2% (n = 47/896), lietojot placebo. Pacientiem, kuri sākotnēji tika ārstēti ar sulfonilurīnvielu saturošu shēmu, smagas sirds mazspējas biežums bija 5,8% (n = 94/1624) ar Actos un 4,4% (n = 71/1626), lietojot placebo.
tops
Piesardzības pasākumi
Vispārīgi
Actos antihiperglikēmiskais efekts ir tikai insulīna klātbūtnē. Tādēļ Actos nevajadzētu lietot pacientiem ar 1. tipa cukura diabētu vai diabētiskās ketoacidozes ārstēšanai.
Hipoglikēmija: Pacientiem, kuri saņem Actos kombinācijā ar insulīnu vai perorāliem hipoglikēmijas līdzekļiem, var būt hipoglikēmijas risks, un var būt nepieciešams samazināt vienlaikus lietoto līdzekļu devu.
Sirds un asinsvadu sistēma: ASV placebo kontrolētos klīniskajos pētījumos, kas izslēdza pacientus ar Ņujorkas Sirds asociācijas (NYHA) III un IV klases sirds stāvokli, nopietnas sirds nevēlamas blakusparādības, kas saistītas ar apjoma palielināšanos, nepalielinājās pacientiem, kurus ārstēja ar Actos monoterapijas veidā vai kombinācijā ar sulfonilurīnvielas atvasinājumiem vai metformīnu pret ar placebo ārstētiem pacientiem. Insulīna kombinācijas pētījumos neliels skaits pacientu ar iepriekšēju vēsturi sirds slimības gadījumā attīstījās sastrēguma sirds mazspēja, ārstējot ar Actos kombinācijā ar insulīnu (skat BRĪDINĀJUMI). Šajos Actos klīniskajos pētījumos pacienti ar NYHA III un IV klases sirds stāvokli netika pētīti. Actos nav indicēts pacientiem ar NYHA III vai IV klases sirds stāvokli.
Pēcpārdošanas pieredzē, lietojot Actos, ziņots par sastrēguma sirds mazspējas gadījumiem pacientiem gan ar, gan bez iepriekš zināmām sirds slimībām.
Tūska: Actos jālieto piesardzīgi pacientiem ar tūsku. Visos ASV klīniskajos pētījumos par tūsku ziņots biežāk pacientiem, kuri tika ārstēti ar Actos, nekā pacientiem, kas ārstēti ar placebo, un šķiet, ka tie ir saistīti ar devu (skatīt NEVĒLAMĀS REAKCIJAS). Pēcreģistrācijas periodā ir saņemti ziņojumi par tūskas sākšanos vai pasliktināšanos. Tā kā tiazolidīndioni, ieskaitot Actos, var izraisīt šķidruma aizturi, kas var saasināt vai izraisīt sastrēguma sirds mazspēju, Actos jālieto piesardzīgi pacientiem ar sirds mazspējas risku. Pacienti jānovēro, vai nav sirds mazspējas pazīmju un simptomu (skatīt BOXED BRĪDINĀJUMS, BRĪDINĀJUMI, un PIESARDZĪBAS PASĀKUMI).
Svara pieaugums: Ar devu saistīts svara pieaugums tika novērots, lietojot tikai Actos un kombinācijā ar citiem hipoglikēmiskiem līdzekļiem (6. tabula). Svara pieauguma mehānisms nav skaidrs, bet, iespējams, tas saistīts ar šķidruma aizturi un tauku uzkrāšanos.
6. tabula Svara izmaiņas (kg), salīdzinot ar sākotnējo līmeni, Actos dubultmaskētu klīnisko pētījumu laikā
| Kontroles grupa (Placebo) |
Actos 15 mg |
Actos 30 mg |
Actos 45 mg |
||
| Mediāna (25th/75th procentile) |
Mediāna (25th/75th procentile) |
Mediāna (25th/75th procentile) |
Mediāna (25th/75th procentile) |
||
| Monoterapija | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinētā terapija | Sulfonilurīnviela | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| Metformīns | -1.4 (-3.2/0.3) n = 160 |
Nav | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| Insulīns | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Piezīme: izmēģinājuma ilgums no 16 līdz 26 nedēļām |
Ovulācija: Terapija ar Actos, tāpat kā citi tiazolidīndioni, dažām sievietēm pirmsmenopauzes periodā var izraisīt ovulāciju. Tā rezultātā šiem pacientiem, lietojot Actos, var būt paaugstināts grūtniecības risks. Tādēļ sievietēm pirmsmenopauzes periodā ieteicams ieteikt atbilstošu kontracepcijas metodi. Šī iespējamā ietekme nav pētīta klīniskajos pētījumos, tāpēc šīs parādīšanās biežums nav zināms.
Hematoloģiski: Actos var izraisīt hemoglobīna un hematokrīta līmeņa pazemināšanos. Visos klīniskajos pētījumos vidējais hemoglobīna līmenis samazinājās par 2% līdz 4% pacientiem, kuri tika ārstēti ar Actos. Šīs izmaiņas galvenokārt notika pirmo 4–12 terapijas nedēļu laikā un pēc tam saglabājās salīdzinoši nemainīgas. Šīs izmaiņas var būt saistītas ar palielinātu plazmas tilpumu un reti saistītas ar nozīmīgu hematoloģisko klīnisko iedarbību (sk NEVĒLAMĀS REAKCIJAS, Laboratorijas anomālijas).
Iedarbība uz aknām: iepriekš apstiprinātos klīniskajos pētījumos visā pasaulē vairāk nekā 4500 cilvēku ārstēja ar Actos. ASV klīniskajos pētījumos Actos saņēma vairāk nekā 4700 pacienti ar 2. tipa cukura diabētu. Klīniskajos pētījumos nebija pierādījumu par zāļu izraisītu hepatotoksicitāti vai ALAT līmeņa paaugstināšanos.
Iepriekš apstiprinātu placebo kontrolētu klīnisko pētījumu laikā ASV kopumā 4 no 1526 (0,26%) pacientiem ārstēti ar Actos, un 2 no 793 (0,25%) placebo ārstētiem pacientiem ALAT vērtības bija â ‰ times trīs reizes lielākas nekā normāli. ALAT līmeņa paaugstināšanās pacientiem, kurus ārstēja ar Actos, bija atgriezeniska un nebija skaidri saistīta ar terapiju ar Actos.
Pēcpārdošanas pieredzē ar Actos ir saņemti ziņojumi par hepatītu un aknu enzīmu līmeņa paaugstināšanos līdz 3 vai vairāk reizes virs normas augšējās robežas. Ļoti reti šie ziņojumi ir saistīti ar aknu mazspēju ar letālu iznākumu vai bez tā, kaut arī cēloņsakarība nav noskaidrota.
Kamēr nav pieejami papildu lielu, ilgtermiņa kontrolētu klīnisko pētījumu un papildu pētījumu rezultāti Pēcreģistrācijas drošuma dati pacientiem, kas ārstēti ar Actos, ieteicams periodiski kontrolēt aknas fermenti.
Pirms terapijas uzsākšanas jānovērtē seruma ALAT (alanīna aminotransferāzes) līmenis Actos visiem pacientiem un periodiski pēc tam saskaņā ar veselības aprūpes klīnisko vērtējumu profesionāls. Aknu funkcijas testi jāveic arī pacientiem, ja rodas simptomi, kas norāda uz aknu disfunkciju, piemēram, slikta dūša, vemšana, sāpes vēderā, nogurums, anoreksija vai tumšs urīns. Līdz laboratorijas novērtējumiem, pieņemot lēmumu par pacienta turpināšanu ar Actos, jālemj pēc klīniskā sprieduma. Ja tiek novērota dzelte, zāļu terapija jāpārtrauc.
Terapiju ar Actos nedrīkst uzsākt, ja pacientam ir aktīvas aknu slimības klīniskas pazīmes vai ALAT līmenis pārsniedz 2,5 reizes virs normas augšējās robežas. Pacienti ar nedaudz paaugstinātu aknu enzīmu līmeni (ALAT līmenis 1 līdz 2,5 reizes pārsniedz normas augšējo robežu) plkst Lai noteiktu aknu enzīma cēloni, jānovērtē sākotnējais stāvoklis vai jebkurš Actos terapijas laikā pacēlums. Pacientiem ar nedaudz paaugstinātu aknu enzīmu līmeni jāuzsāk vai jāturpina Actos terapija piesardzīgi un iekļaujiet atbilstošu klīnisko uzraudzību, kas var ietvert biežāku aknu enzīmu līmeni uzraudzība. Ja paaugstināts transamināžu līmenis serumā (ALAT> 2,5 reizes pārsniedz normas augšējo robežu), aknas funkciju testi jānovērtē biežāk, līdz līmenis atgriežas normālā stāvoklī vai pirms apstrādes vērtības. Ja ALAT līmenis pārsniedz 3 reizes virs normas augšējās robežas, testu vajadzētu atkārtot pēc iespējas ātrāk. Ja ALAT līmenis saglabājas> 3 reizes virs normas augšējās robežas vai ja pacientam ir dzelte, Actos terapija jāpārtrauc.
Makulārā tūska: Pēcreģistrācijas periodā ziņots par makulas tūsku pacientiem ar cukura diabētu, kuri lietoja pioglitazonu vai citu tiazolidīndionu. Dažiem pacientiem bija redzes miglošanās vai samazināta redzes asums, bet dažiem pacientiem, iespējams, tika diagnosticēta kārtējā oftalmoloģiskā izmeklēšana. Dažiem pacientiem laikā, kad tika diagnosticēta makulas tūska, bija perifēra edēma. Dažiem pacientiem maialas edēma uzlabojās pēc tiazolidīndiona lietošanas pārtraukšanas. Nav zināms, vai pastāv cēloņsakarība starp pioglitazonu un makulas edēmu. Saskaņā ar Amerikas Diabēta asociācijas aprūpes standartiem pacientiem ar cukura diabētu regulāri jāveic oftalmologa acu eksāmeni. Turklāt jebkurš diabēta slimnieks, kurš ziņo par jebkāda veida redzes simptomiem, nekavējoties jānosūta pie oftalmologa neatkarīgi no pacienta medikamentiem vai citiem fizikāliem atklājumiem (sk. NEVĒLAMĀS REAKCIJAS).
Lūzumi: randomizētā pētījumā (PROaktīvs) pacientiem ar 2. tipa cukura diabētu (vidējais diabēts 9,5 gadi), sievietēm, kuras lietoja kaulu lūzumu biežumu pioglitazons. Vidējā 34,5 mēnešu novērošanas laikā kaulu lūzumu biežums sievietēm bija 5,1% (44/870) pioglitazonam, salīdzinot ar 2,5% (23/905) placebo. Šī atšķirība tika novērota pēc pirmā ārstēšanas gada un saglabājās pētījuma laikā. Lielākā daļa lūzumu, kas novērotas sievietēm, bija bez mugurkaula lūzumi, ieskaitot apakšējās un distālās augšējās ekstremitātes. Vīriešiem, kas ārstēti ar pioglitazonu 1,7% (30/1735), salīdzinot ar placebo 2,1% (37/1728), lūzumu biežuma palielināšanās netika novērota. Rūpējoties par pacientiem, īpaši sievietēm, kuras ārstē ar, jāapsver lūzumu risks pioglitazons un uzmanība jāpievērš kaulu veselības novērtēšanai un uzturēšanai saskaņā ar pašreizējiem standartiem aprūpes.
Makrovaskulāri iznākumi: Nav klīnisku pētījumu, kas pārliecinoši pierādītu makrovaskulāro risku mazināšanos, lietojot Actos vai citas zāles pret diabētu.
Laboratorijas testi
FPG un HbA1c periodiski jāveic mērījumi, lai kontrolētu glikēmijas kontroli un terapeitisko reakciju uz Actos.
Visiem pacientiem pirms Actos terapijas sākšanas un periodiski pēc tam ieteicams kontrolēt aknu enzīmu līmeni (skatīt veselības aprūpes speciālista klīnisko novērtējumu) (skatīt PIESARDZĪBAS PASĀKUMI, Vispārējā, ietekme uz aknām un NEVĒLAMĀS REAKCIJAS, Seruma transamināžu līmeņi).
Informācija pacientiem
Ir svarīgi norādīt pacientiem ievērot uztura norādījumus un regulāri pārbaudīt glikozes līmeni asinīs un glikozilēto hemoglobīnu. Stresa periodos, piemēram, drudzis, trauma, infekcija vai ķirurģiska iejaukšanās, nepieciešamība pēc medikamentiem var mainīties, un pacienti jāatgādina nekavējoties meklēt medicīnisko palīdzību.
Pacienti, kuriem rodas neparasti straujš svara pieaugums vai tūska vai kuriem rodas elpas trūkums vai citi sirds mazspējas simptomi, lietojot Actos, nekavējoties jāziņo par šiem simptomiem ārsts.
Pacientiem jāinformē, ka pirms terapijas uzsākšanas un periodiski pēc tam aknu funkcijas asins analīzes tiks veiktas saskaņā ar veselības aprūpes speciālista klīnisko lēmumu. Pacientiem jāiesaka nekavējoties meklēt medicīnisku palīdzību, ja rodas neizskaidrojama nelabums, vemšana, sāpes vēderā, nogurums, anoreksija vai tumšs urīns.
Pacientiem jāiesaka lietot Actos vienu reizi dienā. Actos var lietot neatkarīgi no ēdienreizēm. Ja deva tiek izlaista vienā dienā, nākamajā dienā to nedrīkst dubultot.
Lietojot kombinētu terapiju ar insulīnu vai perorāliem hipoglikēmijas līdzekļiem, rodas hipoglikēmijas riski, tās simptomi un ārstēšana un apstākļi, kas predisponē tās attīstību, jāpaskaidro pacientiem un viņu ģimenei locekļi.
Terapija ar Actos, tāpat kā citi tiazolidīndioni, dažām sievietēm pirmsmenopauzes periodā var izraisīt ovulāciju. Tā rezultātā šiem pacientiem, lietojot Actos, var būt paaugstināts grūtniecības risks. Tādēļ sievietēm pirmsmenopauzes periodā ieteicams ieteikt atbilstošu kontracepcijas metodi. Šī iespējamā ietekme nav pētīta klīniskajos pētījumos, tāpēc šīs parādīšanās biežums nav zināms.
Mijiedarbība ar zālēm
In vivo zāļu mijiedarbības pētījumi liecina, ka pioglitazons var būt vājš CYP 450 izoforma 3A4 substrāta induktors (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Metabolisms un Narkotiku un zāļu mijiedarbība).
CYP2C8 enzīmu inhibitors (piemēram, gemfibrozils) var ievērojami palielināt AUC pioglitazons un CYP2C8 enzīmu induktors (piemēram, rifampīns) var ievērojami samazināt AUC pioglitazons. Tāpēc, ja ārstēšanas laikā ar pioglitazonu tiek sākts vai pārtraukts CYP2C8 inhibitors vai induktors, var būt vajadzīgas izmaiņas diabēta ārstēšanā, pamatojoties uz klīnisko atbildes reakciju (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Narkotiku un zāļu mijiedarbība).
Kanceroģenēze, mutaģenēze, auglības pasliktināšanās
Divu gadu kancerogenitātes pētījums tika veikts ar žurku tēviņiem un mātītēm, lietojot perorāli līdz 63 mg / kg devas (aptuveni 14 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem - 45 mg, pamatojoties uz mg / m2). Narkotiku izraisīti audzēji netika novēroti nevienā orgānā, izņemot urīnpūsli. Labdabīgas un / vai ļaundabīgas pārejas šūnu jaunveidojumi tika novēroti žurku tēviņiem ar devu 4 mg / kg dienā un vairāk (aptuveni vienāda ar maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2). Divu gadu kancerogenitātes pētījums tika veikts ar pelēm tēviņiem un mātītēm, lietojot perorāli līdz 100 mg / kg dienā (aptuveni 11 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2). Nevienā orgānā netika novēroti zāļu izraisīti audzēji.
Paredzot urīna citoloģijas novērtējumu, iesaistot vairāk nekā 1800 pacientus, kuri saņēma Actos klīniskajos pētījumos līdz vienam gadam, netika atklāti jauni urīnpūšļa audzēju gadījumi. Divos 3 gadu pētījumos, kuros pioglitazonu salīdzināja ar placebo vai glicurīdu, bija 16/3656 (0,44%). ziņojumi par urīnpūšļa vēzi pacientiem, kuri lieto pioglitazonu, salīdzinot ar 5/3679 (0,14%) pacientiem, kuri nelieto pioglitazons. Izslēdzot pacientus, kuriem pētāmo zāļu iedarbība urīnpūšļa vēža diagnosticēšanas laikā bija mazāka par gadu, bija seši (0,16%) pioglitazona gadījumi un divi (0,05%) placebo.
Pioglitazona HCl nebija mutagēnisks ģenētiskās toksikoloģijas pētījumu laikā, ieskaitot Ames baktēriju testu, zīdītāju šūnu priekšu gēnu mutācijas tests (CHO / HPRT un AS52 / XPRT), in vitro citoģenētikas tests, izmantojot CHL šūnas, neplānots DNS sintēzes tests un in vivo mikrokodols pārbaude.
Lietojot perorālas pioglitazona HCl devas līdz 40 mg / kg dienā, žurku tēviņiem un mātītēm netika novērota negatīva ietekme uz auglību. pirms pārošanās un grūsnības un tās laikā (aptuveni 9 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2).
Dzīvnieku toksikoloģija
Sirds palielināšanās novērota pelēm (100 mg / kg), žurkām (4 mg / kg un vairāk) un suņiem (3 mg / kg), kuras iekšķīgi ārstēja ar pioglitazona HCl (apmēram 11, 1 un 2 reizes pārsniedz maksimālo ieteicamo perorālo devu cilvēkiem, attiecīgi, pelēm, žurkām un suņiem, pamatojoties uz mg / m2). Vienu gadu ilgā pētījumā ar žurkām ar narkotikām saistīta agrīna nāve acīmredzamu sirds disfunkciju dēļ notika perorāla deva 160 mg / kg dienā (aptuveni 35 reizes lielāka par maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2). Sirds palielināšanās tika novērota 13 nedēļu ilgā pētījumā ar pērtiķiem, lietojot perorāli 8,9 mg / kg un vairāk (aptuveni 4 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkam, pamatojoties uz mg / m2), bet ne 52 nedēļu ilgā pētījumā ar perorālām devām līdz 32 mg / kg (aptuveni 13 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2).
Grūtniecība
C grūtniecības kategorija Pioglitazons nebija teratogēns žurkām, lietojot perorāli līdz 80 mg / kg vai trušiem līdz 160 mg / kg organoģenēzes laikā (aptuveni 17 un 40 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem) uz mg / m2, attiecīgi). Aizkavēta atnešanās un embriotoksicitāte (par ko liecina lielāki zaudējumi pēc implantācijas, aizkavēta attīstība un samazināts augļa svars) tika novērotas žurkām, lietojot perorāli 40 mg / kg dienā un vairāk (apmēram 10 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2). Žurku pēcnācējiem netika novērota funkcionālā vai uzvedības toksicitāte. Trušiem embriotoksicitāte tika novērota, lietojot perorāli 160 mg / kg devu (aptuveni 40 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2). Novēlota postnatālā attīstība, kas saistīta ar samazinātu ķermeņa svaru, tika novērota žurku pēcnācējiem, lietojot perorāli 10 mg / kg devas un vairāk, vēlu grūsnības un laktācijas periodos (aptuveni 2 reizes pārsniedzot maksimālo ieteicamo perorālo devu cilvēkiem, pamatojoties uz mg / m2).
Nav piemērotu un labi kontrolētu pētījumu grūtniecēm. Actos grūtniecības laikā drīkst lietot tikai tad, ja potenciālais ieguvums attaisno iespējamo risku auglim.
Tā kā pašreizējā informācija stingri norāda, ka patoloģisks glikozes līmenis asinīs grūtniecības laikā ir saistīts arī ar lielāku iedzimtu anomāliju biežumu, kā arī pieaugot jaundzimušo saslimstībai un mirstībai, vairums ekspertu iesaka lietot grūtniecības laikā insulīnu, lai uzturētu glikozes līmeni asinīs tikpat normālu kā iespējams.
Barojošās mātes
Pioglitazons izdalās žurku laktācijas laikā. Nav zināms, vai Actos izdalās mātes pienā. Tā kā daudzas zāles izdalās mātes pienā, Actos nedrīkst ievadīt sievietēm, kas baro bērnu ar krūti.
Lietošana bērniem
Actos drošība un efektivitāte bērniem nav noteikta.
Gados vecākiem cilvēkiem
Aptuveni 500 pacienti placebo kontrolētos klīniskos pētījumos ar Actos bija 65 un vecāki. Starp šiem un jaunākiem pacientiem nozīmīgas efektivitātes un drošības atšķirības netika novērotas.
tops
Nevēlamās reakcijas
Randomizētos, dubultmaskētos, kontrolētos klīniskos pētījumos ar Actos tika ārstēti vairāk nekā 8500 pacienti ar 2. tipa cukura diabētu. Tajā ietilpst 2605 paaugstināta riska pacienti ar 2. tipa cukura diabētu, kas ārstēti ar Actos no PROactive klīniskā pētījuma. Vairāk nekā 6000 pacientu ārstēja 6 mēnešus vai ilgāk, bet vairāk nekā 4500 pacienti - vienu gadu vai ilgāk. Vairāk nekā 3000 pacientu Actos ir saņēmuši vismaz 2 gadus.
Kopējais nevēlamo blakusparādību biežums un veidi, par kuriem ziņots placebo kontrolētos klīniskos pētījumos ar Actos monoterapiju 7,5 mg, 15 mg, 30 mg vai 45 mg devā vienu reizi dienā, parādīts 7. tabulā.
7. tabula Placebo kontrolēti Actos monoterapijas klīniskie pētījumi: blakusparādības, par kurām ziņots ar biežumu - 5% no pacientiem, kuri ārstēti ar Actos
| (% no pacientiem) | ||
| Placebo N = 259 |
Actos N = 606 |
|
| Infekcija augšējā elpošanas ceļā | 8.5 | 13.2 |
| Galvassāpes | 6.9 | 9.1 |
| Sinusīts | 4.6 | 6.3 |
| Mialģija | 2.7 | 5.4 |
| Zobu traucējumi | 2.3 | 5.3 |
| Cukura diabēta pasliktināšanās | 8.1 | 5.1 |
| Faringīts | 0.8 | 5.1 |
Lielākajai daļai klīnisko blakusparādību biežums bija līdzīgs grupām, kuras ārstēja ar Actos monoterapiju, un tām, kuras ārstēja kombinācijā ar sulfonilurīnvielas atvasinājumiem, metformīnu un insulīnu. Pacientiem, kuri tika ārstēti ar Actos un insulīnu, palielinājās tūskas rašanās, salīdzinot ar tikai insulīnu.
16 nedēļu placebo kontrolētā Actos plus insulīna pētījumā (n = 379) 10 pacienti tika ārstēti ar Actos plus insulīnam attīstījās aizdusa un arī terapijas laikā kādā brīdī attīstījās svara izmaiņas vai tūska. Šo simptomu ārstēšanai septiņi no 10 pacientiem saņēma diurētiskus līdzekļus. Par to netika ziņots insulīna un placebo grupā.
Ar placebo kontrolētu klīnisko pētījumu pārtraukšanas biežums tādu blakusparādību, kas nav hiperglikēmija, dēļ bija līdzīgs pacientiem, kuri tika ārstēti ar placebo (2,8%) vai Actos (3,3%).
Kontrolētos kombinētās terapijas pētījumos ar sulfonilurīnvielu vai insulīnu tika ziņots par vieglu vai mērenu hipoglikēmiju, kas šķietami atkarīga no devas (skatīt PIESARDZĪBAS PASĀKUMI, Vispārīgi, hipoglikēmija un DEVAS UN ADMINISTRĀCIJA, Kombinētā terapija).
ASV dubultaklos pētījumos anēmija tika novērota 2% pacientu, kuri tika ārstēti ar Actos plus sulfonilurīnvielas atvasinājumu, metformīnu vai insulīnu (skatīt PIESARDZĪBAS PASĀKUMI, Vispārīgi, hematoloģiski).
Monoterapijas pētījumos par tūsku ziņots 4,8% (ar devām no 7,5 mg līdz 45 mg) pacientu, kuri tika ārstēti ar Actos, salīdzinot ar 1,2% pacientu, kas saņēma placebo. Kombinētās terapijas pētījumos par tūsku ziņots 7,2% pacientu, kas ārstēti ar Actos un sulfonilurīnvielas atvasinājumiem, salīdzinot ar 2,1% pacientu, kuri lietoja tikai sulfonilurīnvielas atvasinājumus. Kombinētās terapijas pētījumos ar metformīnu par tūsku ziņots 6,0% pacientu, kuri lietoja kombinēto terapiju, salīdzinot ar 2,5% pacientu, kuri lietoja tikai metformīnu. Kombinētās terapijas pētījumos ar insulīnu par tūsku ziņots 15,3% pacientu, kuri saņēma kombinēto terapiju, salīdzinot ar 7,0% pacientu, kuri lietoja tikai insulīnu. Lielāko daļu šo notikumu uzskatīja par vieglu vai vidēji smagu (sk PIESARDZĪBAS PASĀKUMI, Ģenerālis, tūska).
Vienā 16 nedēļu ilgā klīniskā pētījumā ar insulīnu un Actos kombinēto terapiju vairākiem pacientiem attīstījās sastrēguma sirds mazspēja, izmantojot kombinēto terapiju (1,1%), salīdzinot ar nevienu tikai ar insulīnu (skatīt BRĪDINĀJUMI, Sirds mazspēja un citi sirds efekti).
Perspektīvais Pioglitazona klīniskais pētījums makrovaskulāros notikumos (PROaktīvs)
PROaktīvā grupā bija 5238 pacienti ar 2. tipa cukura diabētu un iepriekš bijusi makrovaskulāra slimība apstrādāta ar Actos (n = 2605), papildus titrējot ar spēku līdz 45 mg dienā vai placebo (n = 2633) aprūpes. Gandrīz visi cilvēki (95%) saņēma kardiovaskulāras zāles (beta blokatorus, AKE inhibitorus, ARB, kalcija kanālu blokatorus, nitrātus, diurētiskos līdzekļus, aspirīnu, statīnus, fibrāti). Pacientu vidējais vecums bija 61,8 gadi, vidējais diabēta ilgums 9,5 gadi un vidējais HbA1c 8,1%. Vidējais novērošanas ilgums bija 34,5 mēneši. Šīs tiesas galvenais mērķis bija izpētīt Actos ietekmi uz mirstību un makrovaskulārā saslimstība pacientiem ar 2. tipa cukura diabētu, kuriem bija augsts saslimšanas risks makrovaskulāri notikumi. Primārais efektivitātes mainīgais bija laiks līdz jebkura notikuma pirmās parādīšanās gadījumam kardiovaskulārajā kombinētajā mērķa parametrā (skatīt 8. tabulu zemāk). Lai gan starp Actos un placebo nebija statistiski nozīmīgas atšķirības 3 gadu biežumā Pirmais notikums šajā saliktajā veidā nepalielināja mirstību vai kopējo makrovaskulāro notikumu pieaugumu ar Actos.
8. tabula Katra komponenta pirmo un kopējo notikumu skaits kardiovaskulārajā kompozīta galapunktā
| Placebo N = 2633 |
Actos N = 2605 |
|||
| Sirds un asinsvadu sistēmas notikumi | Pirmie notikumi (N) |
Notikumu kopskaits (N) |
Pirmie notikumi (N) |
Notikumu kopskaits (N) |
| Jebkurš notikums | 572 | 900 | 514 | 803 |
| Mirstība no visiem cēloņiem | 122 | 186 | 110 | 177 |
| Ne fatāls MI | 118 | 157 | 105 | 131 |
| Insults | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Sirds iejaukšanās | 101 | 240 | 101 | 195 |
| Galvenā kājas amputācija | 15 | 28 | 9 | 28 |
| Kāju revaskularizācija | 57 | 92 | 71 | 115 |
Pēcreģistrācijas periodā ir saņemti arī ziņojumi par jaunu diabētiskās makulas tūskas sākšanos vai pasliktināšanos ar samazinātu redzes asumu (sk. PIESARDZĪBAS PASĀKUMI, Vispārējs, makulas tūska).
Laboratorijas anomālijas
Hematoloģiski: Actos var izraisīt hemoglobīna un hematokrīta līmeņa pazemināšanos. Hemoglobīna un hematokrīta līmeņa pazemināšanās, lietojot Actos, šķiet atkarīga no devas. Visos klīniskajos pētījumos vidējais hemoglobīna līmenis samazinājās par 2% līdz 4% pacientiem, kuri tika ārstēti ar Actos. Šīs izmaiņas parasti notika pirmo 4 līdz 12 terapijas nedēļu laikā un pēc tam saglabājās samērā stabilas. Šīs izmaiņas var būt saistītas ar palielinātu plazmas daudzumu, kas saistīts ar Actos terapiju, un reti ir saistītas ar nozīmīgu hematoloģisku klīnisku iedarbību.
Seruma transamināžu līmenis: Visu ASV klīnisko pētījumu laikā 14 no 4780 (0,30%) pacientiem, kuri tika ārstēti ar Actos, ALAT vērtības ārstēšanas laikā bija 3 reizes lielākas par normas augšējo robežu. Visiem pacientiem ar novērošanas vērtībām ALAT līmenis bija atgriezeniski paaugstināts. Ar Actos ārstēto pacientu populācijā bilirubīna, ASAT, ALAT, sārmainās fosfatāzes un GGT vidējās vērtības pēdējā apmeklējuma laikā tika samazinātas salīdzinājumā ar sākotnējo līmeni. Nepilnu 0,9% pacientu, kas ārstēti ar Actos, tika anulēti no klīniskajiem pētījumiem ASV neparastu aknu funkcijas testu dēļ.
Iepriekš apstiprinātos klīniskajos pētījumos nebija neviena idiosinkrātu zāļu reakcijas, kas izraisītu aknu mazspēju (skatīt PIESARDZĪBAS PASĀKUMI, Vispārīgi, ietekme uz aknām).
CPK līmeņi: Nepieciešamo laboratorisko pārbaužu laikā klīniskajos pētījumos tika novērots sporādisks, īslaicīgs kreatīna fosfokināzes līmeņa paaugstināšanās (CPK). 9 pacientiem tika novērots izolēts pacēlums, kas vairāk nekā 10 reizes pārsniedz normas augšējo robežu (vērtības no 2150 līdz 11400 SV / L). Seši no šiem pacientiem turpināja saņemt Actos, divi pacienti bija pabeiguši pētījumu zāles paaugstinātas vērtības laikā un viens pacients pārtrauca pētījumus par zālēm sakarā ar pacēlums. Šīs paaugstināšanās izzuda bez acīmredzamām klīniskām sekām. Šo notikumu saistība ar Actos terapiju nav zināma.
tops
Pārdozēšana
Kontrolētos klīniskajos pētījumos tika ziņots par vienu Actos pārdozēšanas gadījumu. Vīriešu kārtas pacients četrās dienās lietoja 120 mg dienā, pēc tam septiņas dienas - 180 mg dienā. Šajā periodā pacients noliedza jebkādus klīniskos simptomus.
Pārdozēšanas gadījumā jāuzsāk atbilstoša balstterapija, ņemot vērā pacienta klīniskās pazīmes un simptomus.
tops
Devas un ievadīšana
Actos jālieto vienu reizi dienā, neatkarīgi no ēdienreizēm.
Pretdiabēta terapijas vadība ir jāpielāgo individuāli. Ideālā gadījumā reakcija uz terapiju jānovērtē, izmantojot HbA1c kas ir labāks ilgtermiņa glikēmijas kontroles rādītājs nekā tikai FPG. HbA1c atspoguļo glikēmiju pēdējos divos trīs mēnešos. Klīniskajā lietošanā pacientus ieteicams ārstēt ar Actos tik ilgi, cik nepieciešams, lai novērtētu HbA izmaiņas1c (trīs mēneši), ja vien pasliktinās glikēmijas kontrole. Pēc Actos lietošanas uzsākšanas vai palielinot devu, pacienti rūpīgi jānovēro, vai nerodas nevēlamas parādības, kas saistītas ar šķidruma aizturi (skatīt BOXED BRĪDINĀJUMS un BRĪDINĀJUMI).
Monoterapija
Actos monoterapiju pacientiem, kuri netiek pietiekami kontrolēti ar diētu un fizisko aktivitāti, var sākt ar 15 mg vai 30 mg vienu reizi dienā. Pacientiem, kuri nepietiekami reaģē uz sākotnējo Actos devu, devu var palielināt līdz 45 mg vienu reizi dienā. Pacientiem, kuri nepietiekami reaģē uz monoterapiju, jāapsver kombinēta terapija.
Kombinētā terapija
Sulfonilurīnvielas atvasinājumi: Actos kombinācijā ar sulfonilurīnvielas atvasinājumu var sākt lietot pa 15 mg vai 30 mg vienu reizi dienā. Sākot Actos terapiju, pašreizējo sulfonilurīnvielas atvasinājumu devu var turpināt. Ja pacienti ziņo par hipoglikēmiju, jāsamazina sulfonilurīnvielas deva.
Metformīns: Actos kombinācijā ar metformīnu var sākt lietot pa 15 mg vai 30 mg vienu reizi dienā. Sākot Actos terapiju, pašreizējo metformīna devu var turpināt. Maz ticams, ka kombinētās terapijas laikā ar Actos hipoglikēmijas dēļ būs jāpielāgo metformīna deva.
Insulīns: Actos kombinācijā ar insulīnu var sākt lietot pa 15 mg vai 30 mg vienu reizi dienā. Sākot Actos terapiju, pašreizējo insulīna devu var turpināt. Pacientiem, kuri saņem Actos un insulīnu, insulīna devu var samazināt par 10% līdz 25%, ja pacients ziņo par hipoglikēmiju vai ja glikozes koncentrācija plazmā pazeminās līdz mazāk nekā 100 mg / dL. Turpmākās korekcijas jāveic individuāli, pamatojoties uz glikozes līmeni pazeminošo reakciju.
Maksimālā ieteicamā deva
Actos deva nedrīkst pārsniegt 45 mg vienreiz dienā monoterapijā vai kombinācijā ar sulfonilurīnvielu, metformīnu vai insulīnu.
Devas pielāgošana pacientiem ar nieru mazspēju nav ieteicama (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Farmakokinētika un zāļu metabolisms).
Terapiju ar Actos nedrīkst uzsākt, ja pacientam ir aktīvas aknu slimības klīniskas pazīmes vai paaugstināts transamināžu līmenis serumā (ALAT pārsniedz 2,5 reizes virs normas augšējās robežas) terapijas sākumā (skat PIESARDZĪBAS PASĀKUMI, Vispārējā, ietekme uz aknām un KLĪNISKĀ FARMAKOLOĢIJA, Īpašas populācijas, aknu nepietiekamība). Visiem pacientiem pirms Actos terapijas uzsākšanas un periodiski pēc tam ieteicams kontrolēt aknu enzīmu līmeni (skatīt apakšpunktu 4.2) PIESARDZĪBAS PASĀKUMI, Vispārīgi, ietekme uz aknām).
Nav datu par Actos lietošanu pacientiem līdz 18 gadu vecumam; tāpēc Actos nav ieteicams lietot bērniem.
Nav pieejami dati par Actos lietošanu kombinācijā ar citu tiazolidīndionu.
tops
Kā piegādāts
Actos ir pieejams 15 mg, 30 mg un 45 mg tabletēs šādi:
15 mg tablete: balta vai gandrīz balta, apaļa, izliekta, ar dalījumu nesadalīta tablete ar "Actos" vienā pusē un "15" otrā pusē, pieejama:
NDC 64764-151-04 pudeles pa 30
NDC 64764-151-05 pudeles ar 90
NDC 64764-151-06 500 pudeles
30 mg tablete: balta vai gandrīz balta, apaļa, plakana, ar dalījumu nesadalīta tablete ar "Actos" vienā pusē un "30" otrā pusē, pieejama:
NDC 64764-301-14 pudeles pa 30
NDC 64764-301-15 pudeles ar 90
NDC 64764-301-16 pudeles pa 500
45 mg tablete: balta vai gandrīz balta, apaļa, plakana, ar dalījumu nesadalīta tablete ar "Actos" vienā pusē un "45" otrā pusē, pieejama:
NDC 64764-451-24 pudeles pa 30
NDC 64764-451-25 pudeles ar 90
NDC 64764-451-26 pudeles pa 500
UZGLABĀŠANA
Uzglabāt temperatūrā 25 ° C (77 ° F); ekskursijas atļautas līdz 15-30 ° C (59-86 ° F) [skatīt USP kontrolēto telpas temperatūru]. Uzglabāt cieši noslēgtu un sargāt no mitruma un mitruma.
tops
Atsauces
- Dengs, LJ, et al. Gemfibrozila ietekme uz pioglitazona farmakokinētiku. Eur J Clin Pharmacol 2005; 61: 831-836, 1. tabula.
2. Jaakkola, T, et al. Rifampicīna ietekme uz pioglitazona farmakokinētiku. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Tikai Rx
Ražotājs:
Uzņēmums Takeda Pharmaceutical Company Limited
Osaka, Japāna
Tirgo:
Takeda Pharmaceuticals America, Inc.
Viens Takeda Parkway
Deerfield, IL 60015
Actos® ir Takeda Pharmaceutical Company Limited reģistrēta preču zīme un saskaņā ar licenci to izmanto Takeda Pharmaceuticals America, Inc.
Visi pārējie preču zīmju nosaukumi ir to īpašnieku īpašums.
Pēdējoreiz atjaunināts: 08/09
Actos, pioglitazone hcl, informācija par pacientiem (vienkāršā angļu valodā)
Sīkāka informācija par diabēta pazīmēm, simptomiem, cēloņiem, ārstēšanu
Informācija šajā monogrāfijā nav paredzēta visiem iespējamiem lietojumiem, norādījumiem, piesardzības pasākumiem, zāļu mijiedarbību vai nelabvēlīgo iedarbību. Šī informācija ir vispārināta un nav paredzēta kā īpaša medicīniska konsultācija. Ja jums ir jautājumi par lietotajām zālēm vai vēlaties uzzināt vairāk informācijas, sazinieties ar ārstu, farmaceitu vai medmāsu.
atpakaļ uz: Pārlūkojiet visus diabēta medikamentus


