Exubera diabēta ārstēšanai
Zīmols: Exubera
Vispārīgais nosaukums: cilvēka insulīns
Devas forma: inhalācijas pulveris
Saturs:
Apraksts
Klīniskā farmakoloģija
Klīniskie pētījumi
Indikācijas un lietošana
Kontrindikācijas
Brīdinājumi
Piesardzības pasākumi
Mijiedarbība ar zālēm
Nevēlamās reakcijas
Pārdozēšana
Devas un ievadīšana
Kā piegādāts
Exubera, cilvēka insulīns [rDNS izcelsme] Informācija par pacientu (vienkāršā angļu valodā)
Apraksts
Exubera® sastāv no blisteriem, kas satur cilvēka insulīna inhalācijas pulveri, kurus ievada, izmantojot Exubera® Ieelpo. Exubera blisteri satur cilvēka insulīnu, kas ražots, izmantojot rekombinantās DNS tehnoloģiju, izmantojot nepatogēno Escherichia coli (K12) laboratorijas celmu. Ķīmiski cilvēka insulīnam ir empīriskā formula C257H383N65O77S6 un molekulmasa 5808. Cilvēka insulīnam ir šāda primārā aminoskābju secība:
Exubera (cilvēka insulīns [rDNS izcelsme]) Inhalācijas pulveris ir balts vai gandrīz balts pulveris vienas devas blisterī (uzpildes masa, skatīt 1. tabulu). Katrs Exubera vienas devas blisters satur 1 mg vai 3 mg insulīna devu (skatīt 1. tabulu) viendabīgs pulvera sastāvs, kas satur nātrija citrātu (dihidrātu), mannītu, glicīnu un nātriju hidroksīds. Pēc Exubera blistera ievietošanas inhalatorā pacients sūknē inhalatora rokturi un pēc tam nospiež pogu, izraisot blistera caurdurtību. Pēc tam insulīna inhalācijas pulveris tiek izkliedēts kamerā, ļaujot pacientam ieelpot aerosolizēto pulveri.
Standartizētos in vitro testa apstākļos Exubera no inhalatora iemutņa izvada īpašu izdalītu insulīna devu (skatīt 1. tabulu). Daļa no kopējās daļiņu masas tiek izstarota kā smalkas daļiņas, kas spēj sasniegt dziļās plaušas. Blisterī var palikt līdz 45% no 1 mg blistera satura un līdz 25% no 3 mg blistera satura.
1. Tabula. Devu nomenklatūra un informācija
| Aizpildiet masu (mg pulvera) |
Nominālā deva (mg insulīna) |
Izstarotā deva*,†(mg insulīna) |
Smalku daļiņu devac,†(mg insulīna) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Faktiskais plaušām piegādātā insulīna daudzums būs atkarīgs no atsevišķiem pacienta faktoriem, piemēram, iedvesmas plūsmas profila. In vitro emisijas aerosola rādītājus neietekmē, ja plūsmas ātrums pārsniedz 10 L / min.
tops
Klīniskā farmakoloģija
Darbības mehānisms
Primārā insulīna darbība ir glikozes metabolisma regulēšana. Insulīns samazina glikozes koncentrāciju asinīs, stimulējot skeleta muskuļu un tauku perifēro glikozes uzņemšanu un kavējot glikozes veidošanos aknās. Insulīns kavē lipolīzi adipocītos, kavē proteolīzi un uzlabo olbaltumvielu sintēzi.
Farmakokinētika
Absorbcija
Exubera piegādā insulīnu iekšķīgi. Insulīns uzsūcas tikpat ātri kā subkutāni ievadīti ātras darbības insulīna analogi un ātrāk nekā subkutāni ievadīts regulārs cilvēka insulīns veseliem cilvēkiem un pacientiem ar 1. vai 2. tipa diabētu (sk 1. attēls).
1. attēls: Vidējās brīvā insulīna seruma koncentrācijas izmaiņas (µU / ml) pacientiem ar 2. tipa cukura diabētu Pēc No Exubera (6 mg) ieelpotā insulīna un zemādas regulārā cilvēka insulīna vienreizēju devu ievadīšana (18 V)
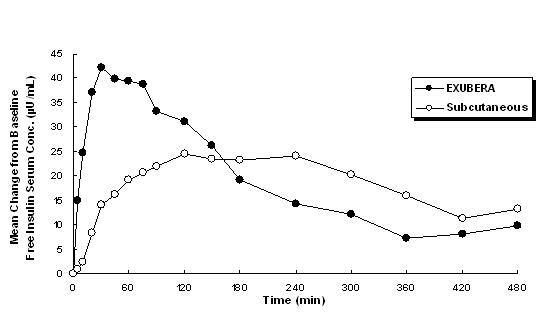
Klīniskajos pētījumos ar pacientiem ar 1. un 2. tipa cukura diabētu pēc Exubera ieelpošanas seruma insulīna koncentrācija maksimālo koncentrāciju sasniedza ātrāk nekā pēc regulāra cilvēka insulīna subkutānas injekcijas - 49 minūtes (diapazons no 30 līdz 90 minūtēm), salīdzinot ar 105 minūtēm (diapazons no 60 līdz 240 minūtēm), attiecīgi.
Klīniskajos pētījumos zemādas regulārā cilvēka insulīna absorbcija samazinājās, palielinoties pacienta ķermeņa masas indeksam (ĶMI). Tomēr insulīna absorbcija pēc Exubera ieelpošanas nebija atkarīga no ĶMI.
Pētījumā ar veseliem cilvēkiem sistemātiska insulīna iedarbība (AUC un Cmax) pēc Exubera palielinājās ar devu diapazonā no 1 līdz 6 mg, ja to lietoja kombinācijā pa 1 un 3 mg pūslīši.
Pētījumā, kurā trīs 1 mg blisteru zāļu forma tika salīdzināta ar vienu 3 mg blisteru, Cmax un AUC pēc trīs 1 mg blisteri bija attiecīgi par aptuveni 30% un 40% lielāki nekā pēc viena 3 mg blistera ievadīšanas (skatīt DEVAS UN ADMINISTRĀCIJA).
Izplatīšana un eliminācija
Tā kā rekombinantā cilvēka insulīns ir identisks endogēnajam insulīnam, sagaidāms, ka sistēmiskais sadalījums un eliminācija būs vienāda. Tomēr Exubera tas nav apstiprināts.
Farmakodinamika
Exubera, tāpat kā subkutāni ievadītiem ātras darbības insulīna analogiem, glikozes līmeņa pazemināšanās aktivitāte sākas daudz ātrāk nekā subkutāni ievadīts parastais cilvēka insulīns. Veseliem brīvprātīgajiem Exubera glikozes līmeni pazeminošās aktivitātes ilgums bija salīdzināms ar subkutānu ievadīts regulārs cilvēka insulīns un garāks nekā zemādas ievadīti ātras darbības insulīna analogi (skatīt 2. attēls).
2. attēls. Vidējais glikozes infūzijas ātrums (GIR), normalizēts līdz GIRmaks katra subjekta ārstēšanai, salīdzinot ar laiku veselīgiem brīvprātīgajiem
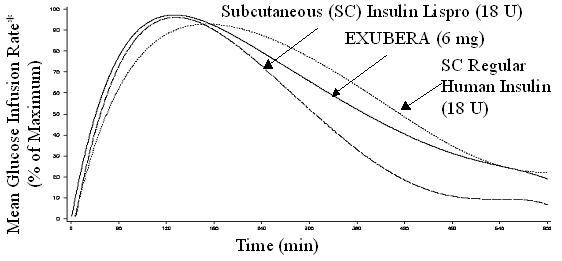
* Noteikts kā infūzijas glikozes daudzums, lai uzturētu nemainīgu glikozes koncentrāciju plazmā, normalizētu līdz maksimālajām vērtībām (procentos no maksimālajām vērtībām); norāda uz insulīna darbību.
Kad Exubera tiek ieelpots, veseliem brīvprātīgajiem glikozes līmeņa pazemināšanās aktivitāte sākas 10-20 minūšu laikā. Maksimālā ietekme uz glikozes līmeņa pazemināšanos rodas aptuveni 2 stundas pēc ieelpošanas. Glikozes līmeni pazeminošās aktivitātes ilgums ir aptuveni 6 stundas.
Pacientiem ar 1. vai 2. tipa cukura diabētu Exubera ir lielāka glikozes līmeni pazeminoša iedarbība pirmajās divās stundās pēc dozēšanas, salīdzinot ar subkutāni ievadītu parasto cilvēka insulīnu.
Exubera glikozes līmeni pazeminošās aktivitātes mainīgums subjektam parasti ir salīdzināms ar subkutāni ievadīta regulārā cilvēka insulīna līmeni pacientiem ar 1. un 2. tipa cukura diabētu.
Īpašās populācijas
Pediatrijas pacienti
Bērniem (6-11 gadu vecumā) un pusaudžiem (12-17 gadiem) ar 1. tipa cukura diabētu Exubera maksimālā insulīna koncentrācijas sasniegšanas laiks bija tiek sasniegts ātrāk nekā ar zemādas parasto cilvēka insulīnu, kas atbilst novērojumiem pieaugušiem pacientiem ar 1. tipu diabēts.
Geriatriski pacienti
Exubera farmakokinētiskajās īpašībās nav acīmredzamu atšķirību, salīdzinot pacientus, kas vecāki par 65 gadiem, un jaunākus pieaugušus pacientus.
Dzimums
Personām ar cukura diabētu un bez tā vīriešiem un sievietēm nenovēroja acīmredzamas Exubera farmakokinētisko īpašību atšķirības.
Sacensības
Pētījums tika veikts ar 25 veseliem kaukāziešu un japāņu diabēta slimniekiem, lai salīdzinātu Exubera farmakokinētiskās un farmakodinamiskās īpašības salīdzinājumā ar parasto cilvēku subkutānu injekciju insulīns. Exubera farmakokinētiskās un farmakodinamiskās īpašības bija salīdzināmas starp abām populācijām.
Aptaukošanās
Exubera absorbcija nav atkarīga no pacienta ĶMI.
Nieru darbības traucējumi
Nieru darbības traucējumu ietekme uz Exubera farmakokinētiku nav pētīta. Pacientiem ar nieru darbības traucējumiem var būt nepieciešama rūpīga glikozes līmeņa kontrole un insulīna devas pielāgošana (skatīt PIESARDZĪBAS PASĀKUMI, Nieru darbības traucējumi).
Aknu darbības traucējumi
Aknu darbības traucējumu ietekme uz Exubera farmakokinētiku nav pētīta. Pacientiem ar aknu darbības traucējumiem var būt nepieciešama rūpīga glikozes līmeņa kontrole un insulīna devas pielāgošana (skatīt PIESARDZĪBAS PASĀKUMI).
Grūtniecība
Exubera absorbcija grūtniecēm ar gestācijas un pirms gestācijas 2. tipa cukura diabētu bija atbilstoša absorbcijai grūtniecēm ar 2. tipa cukura diabētu (skatīt PIESARDZĪBAS PASĀKUMI).
Smēķēšana
Paredzams, ka smēķētājiem Exubera sistēmiskā insulīna iedarbība būs 2 līdz 5 reizes augstāka nekā nesmēķētājiem. Exubera ir kontrindicēts pacientiem, kuri smēķē vai ir pārtraukuši smēķēšanu mazāk nekā 6 mēnešus pirms Exubera terapijas uzsākšanas. Ja pacients sāk vai atsāk smēķēšanu, paaugstinātā hipoglikēmijas riska dēļ Exubera lietošana nekavējoties jāpārtrauc, un jāizmanto alternatīva ārstēšana (skatīt KONTRINDIKĀCIJAS).
Klīniskajos Exubera pētījumos ar 123 pacientiem (no kuriem 69 bija smēķētāji) smēķētāji pieredzēja straujāku glikozes līmeņa pazemināšanas darbību sākšanos. lielāks maksimālais efekts un lielāka kopējā glikozes līmeni pazeminošā iedarbība (īpaši pirmajās 2-3 stundās pēc dozēšanas), salīdzinot ar nesmēķētāji.
Pasīvā cigarešu dūmi
Pretstatā insulīna iedarbības pieaugumam pēc aktīvas smēķēšanas, kad Exubera tika nozīmēts 30 veseliem brīvprātīgajiem, kas nesmēķēja pēc 2 stundu pasīvās cigarešu dūmu iedarbības kontrolētā eksperimentālā vidē insulīna AUC un Cmax samazinājās par aptuveni 20% un 30%, attiecīgi. Exubera farmakokinētika nav pētīta nesmēķētājiem, kuri hroniski pakļauti pasīvo cigarešu dūmu iedarbībai.
Pacienti ar pamata plaušu slimībām
Exubera lietošana pacientiem ar pamata plaušu slimībām, piemēram, astmu vai HOPS, nav ieteicama, jo Exubera drošība un efektivitāte šajā populācijā nav pierādīta (skatīt BRĪDINĀJUMI). Exubera lietošana ir kontrindicēta pacientiem ar nestabilu vai slikti kontrolētu plaušu slimību plašās plazmas dēļ plaušu funkcijas izmaiņas, kas varētu ietekmēt Exubera uzsūkšanos un palielināt hipoglikēmijas risku vai hiperglikēmija (sk KONTRINDIKĀCIJAS).
Farmakokinētikas pētījumā ar 24 pacientiem bez diabēta ar vieglu astmu insulīna uzsūkšanās pēc Bez ārstēšanas ar bronhodilatatora līdzekļiem Exubera bija aptuveni par 20% mazāka nekā absorbcija, kas novērota pacientiem, kuriem nav astma. Tomēr pētījumā, kurā piedalījās 24 pacienti bez diabēta ar hronisku obstruktīvu plaušu slimību (HOPS), iedarbība pēc Exubera ievadīšanas bija aptuveni divas reizes augstāka nekā normāliem cilvēkiem bez HOPS (sk PIESARDZĪBAS PASĀKUMI).
Albuterola lietošana 30 minūtes pirms Exubera ievadīšanas pacientiem bez diabēta ar vieglu astmu (n = 36) un ar mērenu astmas (n = 31) rezultātā insulīna AUC un Cmax palielinājās vidēji par 25 līdz 50%, salīdzinot ar gadījumiem, kad Exubera lietoja vienu pašu (skatīt PIESARDZĪBAS PASĀKUMI).
tops
Klīniskie pētījumi
Exubera drošība un efektivitāte ir pētīta aptuveni 2500 pieaugušiem pacientiem ar 1. un 2. tipa cukura diabētu. Primārais efektivitātes parametrs lielākajā daļā pētījumu bija glikēmijas kontrole, ko mēra ar hemoglobīna A1c (HbA1c) samazinājumu no sākotnējā līmeņa.
1. tipa diabēts
24 nedēļu randomizēts, atklāts, aktīvās kontroles pētījums (A pētījums) tika veikts pacientiem ar 1. tipa cukura diabētu, lai novērtētu Exubera ievada pirms ēdienreizes trīs reizes dienā (TID) ar vienu nakti Humulin® U Ultralente® (cilvēka insulīna pagarinātā cinka suspensija) injekciju (n = 136). Salīdzinošā terapija bija regulārs subkutāns cilvēka insulīns, ievadīts divas reizes dienā (BID). (pirms brokastīm un pirms vakariņām) ar NPH cilvēka insulīna (cilvēka insulīna izofāna suspensijas) injekciju divreiz dienā. (n = 132). Šajā pētījumā vidējais vecums bija 38,2 gadi (diapazons: no 20 līdz 64 gadiem), un 52% cilvēku bija vīrieši.
Otram 24 nedēļu, randomizētam, atklātam, aktīvās kontroles pētījumam (B pētījums) tika veikts pacientiem ar 1. tipa cukura diabētu, lai novērtētu Exubera (n = 103) drošība un efektivitāte, salīdzinot ar zemādas parasto cilvēka insulīnu (n = 103), ja to lieto trīs reizes dienā pirms ēdienreizes. Abās ārstēšanas grupās NPH cilvēka insulīns tika ievadīts divreiz dienā (no rīta un pirms gulētiešanas) kā pamata insulīnu. Šajā pētījumā vidējais vecums bija 38,4 gadi (diapazons: no 19 līdz 65 gadiem), un 54% cilvēku bija vīrieši.
Katrā pētījumā HbA1c samazināšanās un hipoglikēmijas biežums bija salīdzināmi abās ārstēšanas grupās. Ar Exubera ārstētiem pacientiem glikozes līmenis plazmā tukšā dūšā bija mazāks nekā salīdzinošās grupas pacientiem. Pacientu procentuālais daudzums, kas sasniedz HbA1c līmeni <8% (uz vienu Amerikas Diabēta asociācijas ārstēšanas pasākumu Līmenis pētījuma veikšanas laikā) un HbA1c līmenis <7% bija salīdzināms starp abām ārstēšanas grupām. A un B pētījumu rezultāti ir parādīti 2. tabulā.
2. tabula: Divu 24 nedēļu aktīvās kontroles, atklātu pētījumu rezultāti pacientiem ar 1. tipa cukura diabētu (A un B pētījums)
| A pētījums | B pētījums | |||
|---|---|---|---|---|
| Exubera (TID) + LU (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Parauga lielums | 136 | 132 | 103 | 103 |
| LU = Humulīns® U Ultralente®; SC R = subkutāns parastais cilvēka insulīns | ||||
| ||||
| HbA1c (%) | ||||
| Sākotnējais vidējais | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera mīnus SC R* | 0.14 | -0.11 | ||
| 95% TI ārstēšanas atšķirībai | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | ||||
| Sākotnējais vidējais | 191 | 198 | 178 | 191 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -32 | -6 | -23 | 13 |
| Exubera mīnus SC R | -27 | -35 | ||
| 95% TI ārstēšanas atšķirībai | (-47, -6) | (-58, -13) | ||
| 2 h pēcprandiālas glikozes koncentrācija (mg / dL) | ||||
| Sākotnējais vidējais | 283 | 305 | 273 | 293 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -21 | 14 | -1 | -3 |
| Exubera mīnus SC R | -35 | 2 | ||
| 95% TI ārstēšanas atšķirībai | (-61, -8) | (-29, 32) | ||
| Pacienti ar HbA pētījuma beigām1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Pacienti ar HbA pētījuma beigām1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Ķermeņa masa | ||||
| Sākotnējais vidējais (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera mīnus SC R | -0.72 | -0.24 | ||
| 95% TI ārstēšanas atšķirībai | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Pētījuma beigu dienas insulīna deva | ||||
| Īslaicīgas darbības insulīns | 13,4 mgc | 18,3 SV | 10,9 mgc | 25,7 SV |
| Ilgstošas darbības insulīns | 26,4 SV | 37,1 SV | 31,5 SV | 31,9 SV |
2. tipa diabēts
Monoterapija pacientiem, kuri nav optimāli kontrolēti ar diētu un vingrojumu ārstēšanu
12 nedēļu nejaušināts, atklāts, aktīvās kontroles pētījums (C pētījums) tika veikts pacientiem ar 2. tipa cukura diabētu ne optimāli ko kontrolē ar diētu un fiziskiem vingrinājumiem, novērtējot TID Exubera pirms ēšanas (n = 75) drošību un efektivitāti salīdzinājumā ar insulīnu sensibilizējošs līdzeklis. Šajā pētījumā vidējais vecums bija 53,7 gadi (diapazons: 28–80), 55% cilvēku bija vīrieši un vidējais ķermeņa masas indekss bija 32,3 kg / m2.
Pēc 12 nedēļām HbA1c līmenis pacientiem, kuri tika ārstēti ar Exubera, samazinājās par 2,2% (SD = 1,0), salīdzinot ar sākotnējo līmeni 9,5% (SD = 1,1). Ar Exubera ārstēto pacientu proporcija, kas sasniedz HbA pētījuma beigās1c līmenis <8% pieauga līdz 82,7%. Ar Exubera ārstēto pacientu proporcija, kas sasniedz HbA pētījuma beigās1c līmenis
Monoterapija un papildterapija pacientiem, kuri iepriekš ārstēti ar perorālo līdzekļu terapiju
12 nedēļu, randomizēts, atklāts, aktīvās kontroles pētījums (D pētījums) tika veikts pacientiem ar tipu 2 diabēts, kuri pašlaik tika ārstēti, bet bija slikti kontrolēti, izmantojot divus perorālos līdzekļus (OA). Sākotnējie OAs ietvēra insulīna sekrēciju un metformīnu vai tiazolidīndionu. Pacienti tika randomizēti vienā no trim grupām: turpināja tikai OA terapiju (n = 96), pāriet uz TID Exubera monoterapija pirms ēšanas pirms ēdienreizes (n = 102) vai TID Exubera pievienošana pirms maltītes ilgstošai OA terapijai (n = 100). Šajā pētījumā vidējais vecums bija 57,4 gadi (diapazons: 33–80), 66% cilvēku bija vīrieši un vidējais ķermeņa masas indekss bija 30 kg / m2.
Exubera monoterapija un Exubera kombinācijā ar OA terapiju bija pārāka par tikai OA terapiju, samazinot HbA1c līmeņi no bāzes līnijas. Hipoglikēmijas biežums abās Exubera terapijas grupās bija nedaudz augstāks nekā tikai OA terapijas grupā. Salīdzinot tikai ar OA terapiju, to pacientu procentuālais daudzums, kuri sasniedz HbA1c līmenis <8% (saskaņā ar Amerikas Diabēta asociācijas ārstēšanas līmeni pētījuma veikšanas laikā) un HbA1c līmenis <7% bija augstāks pacientiem, kuri tika ārstēti ar Exubera monoterapiju un Exubera kombinācijā ar OA terapiju. Pacientiem abās Exubera terapijas grupās glikozes līmenis plazmā tukšā dūšā bija mazāks nekā pacientiem, kuri tika ārstēti tikai ar OA. D pētījuma rezultāti parādīti 3. tabulā.
3. tabula: 12 nedēļu aktīvās kontroles, atklāta pētījuma rezultāti pacientiem ar 2. tipa diabētu, kuru optimāli nekontrolē ar duālā perorālā līdzekļa terapiju (D pētījums)
| D pētījums | Exubera monoterapija | OAs* | Exubera + OA |
|---|---|---|---|
| Parauga lielums | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Sākotnējais vidējais | 9.3 | 9.3 | 9.2 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -1.4 | -0.2 | -1.9 |
| Exubera grupa mīnus OA†| -1.18†,c, § | -1.67†, ¶, § | |
| 95% TI ārstēšanas atšķirībai | (-1.41, -0.95) | (-1.90, -1.44) | |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | |||
| Sākotnējais vidējais | 203 | 203 | 195 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -23 | 1 | -53 |
| Exubera grupa mīnus OA | -24c | -53 ¶ | |
| 95% TI ārstēšanas atšķirībai | (-36, -11) | (-66, -41) | |
| Pacienti ar HbA pētījuma beigām1c < 8%# | 55.9% | 18.8% | 86.0% |
| Pacienti ar HbA pētījuma beigām1c < 7% | 16.7% | 1.0% | 32.0% |
| Ķermeņa masa | |||
| Sākotnējais vidējais (kg) | 89.5 | 88.0 | 88.6 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni (kg) | 2.8 | 0.0 | 2.7 |
| Exubera grupa mīnus OA | 2.80c | 2.75 ¶ | |
| 95% TI ārstēšanas atšķirībai | (1.94, 3.65) | (1.89, 3.61) |
24 nedēļu, randomizēts, atklāts, aktīvās kontroles pētījums (E pētījums) tika veikts pacientiem ar 2. tipa cukura diabētu, kuri pašlaik saņem sulfonilurīnvielas atvasinājumu. Šis pētījums bija paredzēts, lai novērtētu drošību un efektivitāti, pievienojot Exubera pirms ēdienreizes, lai turpinātu sulfonilurīnvielas atvasinājumu terapija (n = 214), salīdzinot ar metformīna pirms ēšanas pievienošanu turpinātajai sulfonilurīnvielas atvasinājumu terapijai (n = 196). Pacienti tika stratificēti atbilstoši HbA1c 1. nedēļā. Tika definēti divi slāņi: zems HbA1c slānis (HbA1c â ‰ 9 8% līdz â A ¤ 9,5%) un augsts HbA1c slānis (HbA1c > 9,5 līdz â ‰ ¤12%).
Exubera kombinācijā ar sulfonilurīnvielu bija pārāka par metformīnu un sulfonilurīnvielu, samazinot HbA1c vērtības no sākotnējā līmeņa augsta slāņa grupā. Exubera kombinācijā ar sulfonilurīnvielu bija salīdzināms ar metformīnu kombinācijā ar sulfonilurīnvielu, samazinot HbA1c vērtības no sākotnējās vērtības zemā slāņa grupā. Hipoglikēmijas biežums bija lielāks pēc Exubera pievienošanas sulfonilurīnvielas atvasinājumiem nekā pēc metformīna pievienošanas sulfonilurīnvielas atvasinājumam. Pacientu procentuālais daudzums, kuri sasniedza mērķa HbA1c vērtības 8% un 7%, bija salīdzināms starp ārstēšanas grupām abos slāņos, tāpat kā glikozes līmeņa pazemināšanās tukšā dūšā plazmā (sk. 4. tabula).
Vēl viens 24 nedēļu, randomizēts, atklāts, aktīvās kontroles pētījums (F pētījums) tika veikts pacientiem ar 2. tipa cukura diabētu, kuri šobrīd saņem metformīna terapiju. Šis pētījums bija paredzēts, lai novērtētu drošību un efektivitāti, pievienojot Exubera pirms ēdienreizes, lai turpinātu terapija ar metformīnu (n = 234), salīdzinot ar glibenklamīda pievienošanu pirms ēdienreizēm ilgstošai metformīna terapijai (n = 222). Šī pētījuma subjekti tika arī stratificēti vienā no diviem slāņiem, kā noteikts E pētījumā.
Exubera kombinācijā ar metformīnu HbA reducēšanā bija pārāks par glibenklamīdu un metformīnu1c vērtības no bāzes līnijas un mērķa HbA sasniegšana1c vērtības augstā slāņa grupā. Exubera kombinācijā ar metformīnu bija salīdzināms ar glibenklamīdu kombinācijā ar metformīnu, samazinot HbA1c vērtības no bāzes līnijas un mērķa HbA sasniegšana1c vērtības zemā slāņa grupā. Pēc Exubera pievienošanas metformīnam hipoglikēmijas biežums bija nedaudz augstāks nekā pēc glibenklamīda pievienošanas metformīnam. Glikozes līmeņa samazināšana tukšā dūšā plazmā bija salīdzināma starp ārstēšanas grupām (sk 4. tabula).
4. tabula. Divu 24 nedēļu aktīvās kontroles, atklātu pētījumu rezultāti pacientiem ar 2. tipa diabētu, kas iepriekš ārstēti ar perorāliem līdzekļiem (E un F pētījums).
| E pētījums | F pētījums | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Met*+ SU* | Exubera + SU* | Met*+ SU* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Augsts slānis†| Zems slānis†| Augsts slānis†| Zems slānis†| |||||
| Parauga lielums | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Sākotnējais vidējais | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera mīnus OAc | -0.38c, § | -0.07 | -0.37c, ¶ | 0.04 | ||||
| 95% TI ārstēšanas atšķirībai | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | ||||||||
| Sākotnējais vidējais | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera mīnus OA | 1 | 4 | -2 | 4 | ||||
| 95% TI ārstēšanas atšķirībai | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Subjekti ar pētījuma beigām HbA1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Subjekti ar pētījuma beigām HbA1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Ķermeņa masa | ||||||||
| Sākotnējais vidējais (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera mīnus OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% TI ārstēšanas atšķirībai | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Lietošana pacientiem, kas iepriekš ārstēti ar zemādas insulīnu
24 nedēļu nejaušināts, atklāts, aktīvās kontroles pētījums (G pētījums) tika veikts pacientiem, kas ārstēti ar insulīnu ar 2. tipu diabēts, lai novērtētu Exubera ievadītā TID pirms ēšanas drošību un efektivitāti ar vienu nakts injekciju naktī Humulīns® U Ultralente® (n = 146), salīdzinot ar zemādas regulāru cilvēka insulīnu, ko ievada BID (pirms brokastīm un pirms vakariņām) ar NPH cilvēka insulīna injekciju divreiz dienā (n = 149). Šajā pētījumā vidējais vecums bija 57,5 gadi (diapazons: 23–80), 66% cilvēku bija vīrieši un vidējais ķermeņa masas indekss bija 30,3 kg / m2.
HbA samazinājums no sākotnējā līmeņa1c, procenti pacientu, kas sasnieguši HbA1c līmenis <8% (saskaņā ar Amerikas Diabēta asociācijas ārstēšanas līmeni pētījuma veikšanas laikā) un HbA1c līmenis <7%, kā arī hipoglikēmijas rādītāji bija līdzīgi starp ārstēšanas grupām. Ar Exubera ārstētiem pacientiem glikozes līmenis plazmā tukšā dūšā bija mazāks nekā salīdzinošās grupas pacientiem. G pētījuma rezultāti parādīti 5. tabulā.
5. tabula: 24 nedēļu aktīvās kontroles, atklāta pētījuma rezultāti pacientiem ar 2. tipa diabētu, kas iepriekš ārstēti ar zemādas insulīnu (G pētījums)
| Pētījums G | Exubera (TID) + LU (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Parauga lielums | 146 | 149 |
| LU = Humulīns® U Ultralente®; SC R = subkutāns parastais cilvēka insulīns | ||
| ||
| HbA1c (%) | ||
| Sākotnējais vidējais | 8.1 | 8.2 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -0.7 | -0.6 |
| Exubera mīnus SC R* | -0.07 | |
| 95% TI ārstēšanas atšķirībai | (-0.31, 0.17) | |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | ||
| Sākotnējais vidējais | 152 | 159 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni | -22 | -6 |
| Exubera mīnus SC R | -16.36 | |
| 95% TI ārstēšanas atšķirībai | (-27.09, -5.36) | |
| Pacienti ar HbA pētījuma beigām1c < 8%†| 76.0% | 69.1% |
| Pacienti ar HbA pētījuma beigām1c < 7% | 45.2% | 32.2% |
| Ķermeņa masa | ||
| Sākotnējais vidējais (kg) | 90.6 | 89.0 |
| Adj. vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni (kg) | 0.1 | 1.3 |
| Exubera mīnus SC R | -1.28 | |
| 95% TI ārstēšanas atšķirībai | (-1.96, -0.60) | |
| Pētījuma beigu dienas insulīna deva | ||
| Īslaicīgas darbības insulīns | 16,6 mgc | 25,5 SV |
| Ilgstošas darbības insulīns | 37,9 SV | 52,3 SV |
tops
Indikācijas un lietošana
Exubera ir paredzēts pieaugušu pacientu ar cukura diabētu ārstēšanai hiperglikēmijas kontrolei. Exubera darbības sākums ir līdzīgs ātras darbības insulīna analogiem, un tā glikozes līmeni pazeminošās aktivitātes ilgums ir salīdzināms ar subkutāni ievadītu parasto cilvēka insulīnu. Pacientiem ar 1. tipa cukura diabētu Exubera jālieto shēmās, kas ietver ilgstošākas darbības insulīnu. Pacientiem ar 2. tipa cukura diabētu Exubera var lietot monoterapijas veidā vai kombinācijā ar perorāliem līdzekļiem vai ilgstošākas darbības insulīniem.
tops
Kontrindikācijas
Exubera ir kontrindicēts pacientiem ar paaugstinātu jutību pret Exubera vai kādu no tā palīgvielām.
Exubera ir kontrindicēts pacientiem, kuri smēķē vai ir pārtraukuši smēķēšanu mazāk nekā 6 mēnešus pirms Exubera terapijas uzsākšanas. Ja pacients sāk vai atsāk smēķēšanu, paaugstinātā hipoglikēmijas riska dēļ Exubera lietošana nekavējoties jāpārtrauc, un jāizmanto alternatīva ārstēšana (skatīt KLĪNISKĀ FARMAKOLOĢIJA, īpašas populācijas, smēķēšana). Exubera drošība un efektivitāte pacientiem, kas smēķē, nav pierādīta.
Exubera ir kontrindicēts pacientiem ar nestabilu vai slikti kontrolētu plaušu slimību plašu atšķirību dēļ plaušu funkcijā, kas varētu ietekmēt Exubera uzsūkšanos un palielināt hipoglikēmijas risku vai hiperglikēmija.
tops
Brīdinājumi
Exubera atšķiras no parastā cilvēka insulīna ar ātru darbības sākumu. Lietojot kā ēdienreizes insulīnu, Exubera deva jāievada 10 minūšu laikā pirms ēšanas.
Hipoglikēmija ir insulīna terapijas, tai skaitā Exubera, visbiežāk novērotais nevēlamais notikums. Hipoglikēmijas laiks dažādos insulīna preparātos var atšķirties.
Pacientiem ar 1. tipa cukura diabētu nepieciešams arī ilgstošākas darbības insulīns, lai uzturētu pietiekamu glikozes līmeņa kontroli.
Jebkuras insulīna izmaiņas jāveic piesardzīgi un tikai ārsta uzraudzībā. Insulīna stipruma, ražotāja, tipa (piemēram, parastā, NPH, analogi) vai sugas (dzīvnieka, cilvēka) izmaiņas var izraisīt nepieciešamību mainīt devu. Var būt jāpielāgo vienlaicīga perorāla pretdiabēta terapija.
Glikozes līmeņa kontrole ir ieteicama visiem diabēta pacientiem.
Tā kā Exubera ietekmē plaušu darbību, visiem pacientiem pirms Exubera terapijas uzsākšanas jāveic plaušu funkcijas novērtēšana (skatīt PIESARDZĪBAS PASĀKUMI: Plaušu funkcija).
Exubera lietošana pacientiem ar pamata plaušu slimībām, piemēram, astmu vai HOPS, nav ieteicama, jo Exubera drošība un efektivitāte šajā populācijā nav pierādīta (skatīt PIESARDZĪBAS PASĀKUMI: Pamatā esošā plaušu slimība).
Exubera klīniskajos pētījumos ir bijuši 6 no jauna diagnosticēti primāru plaušu ļaundabīgo audzēju gadījumi pacientiem, kas ārstēti ar Exubera, un 1 no jauna diagnosticēts gadījums, salīdzinot ar pacientiem, kas ārstēti ar salīdzinošo terapiju. Pēcreģistrācijas periodā ziņots arī par primāru plaušu ļaundabīgu audzēju ar Exubera ārstētu pacientu. Kontrolētos Exubera klīniskajos pētījumos jauna primārā plaušu vēža sastopamība uz 100 pacienta gadiem pētījuma zāļu iedarbības bija 0,13. (5 gadījumi vairāk nekā 3900 pacienta gadu) ar Exubera ārstētiem pacientiem un 0,02 (1 gadījums vairāk nekā 4100 pacienta gados) ar salīdzināšanas terapiju ārstētiem pacientiem. Bija pārāk maz gadījumu, lai noteiktu, vai šo notikumu rašanās ir saistīta ar Exubera. Visiem pacientiem, kuriem tika diagnosticēts plaušu vēzis, iepriekš bija bijusi cigarešu smēķēšana.
tops
Piesardzības pasākumi
Vispārīgi
Tāpat kā visiem insulīna preparātiem, arī Exubera darbības laiks dažādiem cilvēkiem vai vienam un tam pašam indivīdam var atšķirties. Jebkura insulīna devas pielāgošana var būt nepieciešama, ja pacienti maina savu fizisko aktivitāti vai parasto ēdienreizes plānu. Nepieciešamība pēc insulīna var mainīties tādos periodiskos apstākļos kā slimība, emocionāli traucējumi vai stress.
Hipoglikēmija
Tāpat kā ar visiem insulīna preparātiem, ar Exubera lietošanu var būt saistītas hipoglikēmiskās reakcijas. Straujas glikozes koncentrācijas izmaiņas serumā var izraisīt simptomus, kas līdzīgi hipoglikēmijai diabēta slimniekiem neatkarīgi no glikozes līmeņa. Hipoglikēmijas agrīnās brīdināšanas simptomi noteiktos apstākļos, piemēram, ilgi, var būt atšķirīgi vai mazāk izteikti diabēta ilgums, diabētiskā nervu slimība, tādu zāļu kā beta blokatori lietošana vai pastiprināta diabēta kontrole (skat PIESARDZĪBAS PASĀKUMI: Zāļu mijiedarbība). Šādas situācijas var izraisīt smagu hipoglikēmiju (un, iespējams, samaņas zudumu), pirms pacienti apzinās hipoglikēmiju.
Nieru darbības traucējumi
Nav veikti pētījumi pacientiem ar nieru darbības traucējumiem. Tāpat kā citiem insulīna preparātiem, pacientiem ar nieru darbības traucējumiem var samazināties Exubera devas nepieciešamība (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Īpašās populācijas).
Aknu darbības traucējumi
Nav veikti pētījumi pacientiem ar aknu darbības traucējumiem. Tāpat kā citiem insulīna preparātiem, pacientiem ar aknu darbības traucējumiem var samazināties Exubera devas nepieciešamība (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Īpašās populācijas).
Alerģija
Sistēmiska alerģija
Klīniskajos pētījumos kopējais alerģisko reakciju biežums pacientiem, kuri tika ārstēti ar Exubera, bija līdzīgs tam, kas novērojams pacientiem, kuri lieto subkutānas shēmas ar regulāru cilvēka insulīnu.
Tāpat kā citiem insulīna preparātiem, var rasties reta, bet potenciāli nopietna, vispārēja alerģija pret insulīnu, kas var izraisīt izsitumi (ieskaitot niezi) visā ķermenī, elpas trūkums, sēkšana, asinsspiediena pazemināšanās, ātrs pulss vai svīšana. Smagi vispārējas alerģijas gadījumi, ieskaitot anafilaktiskas reakcijas, var būt bīstami dzīvībai. Ja šādas reakcijas rodas no Exubera, Exubera lietošana jāpārtrauc un jāapsver alternatīva terapija.
Antivielu ražošana
Ārstēšanas laikā ar visiem insulīna preparātiem, ieskaitot Exubera, var veidoties antivielas pret insulīnu. Exubera klīniskajos pētījumos, kad salīdzināmais preparāts bija zemādas insulīns, insulīna antivielu līmeņa paaugstināšanās (ko atspoguļo insulīna saistīšanas aktivitāte) bija ievērojami lielāka pacientiem, kuri saņēma Exubera, nekā pacientiem, kuri saņēma zemādas insulīnu tikai. Exubera klīnisko pētījumu laikā šo antivielu klīniskās sekas netika identificētas; tomēr šī antivielu veidošanās palielināšanās ilgtermiņa klīniskā nozīme nav zināma.
Elpošanas
Plaušu funkcija
Klīniskajos pētījumos, kas ilga līdz diviem gadiem, pacientiem, kuri tika ārstēti ar Exubera, tika konstatēta lielāka plaušu funkcijas samazināšanās, īpaši piespiedu izelpas tilpums vienā sekundē (FEV1) un oglekļa monoksīda izkliedēšanas spēja (DLCO), nekā apstrādāts ar salīdzināšanas līdzekli pacientiem. Tika atzīmēta vidējā ārstēšanas grupas atšķirība plaušu funkcijā, dodot labumu salīdzinošajai grupai pirmās vairākas ārstēšanas nedēļas ar Exubera, un divu gadu ārstēšanas periodā tās nemainījās (Skatīt NEVĒLAMĀS REAKCIJAS: Plaušu funkcija).
Kontrolēto klīnisko pētījumu laikā atsevišķiem pacientiem novēroja ievērojamu plaušu funkcijas samazināšanos abās terapijas grupās. Pēdējā novērojuma laikā FEV1 samazināšanās par â ‰ ‰ 20% salīdzinājumā ar sākotnējo rādītāju bija 1,5% ar Exubera ārstēto un 1,3% ar salīdzinājumu ārstēto pacientu. Samazināšanās no sākotnējā DL līmeņaCO no 20% no pēdējās novērošanas reizes bija 5,1% ar Exubera ārstēto pacientu un 3,6% pacientu, kas ārstēti ar salīdzinošo terapiju.
Tā kā Exubera ietekmē plaušu darbību, visiem pacientiem pirms Exubera terapijas uzsākšanas jāveic spirometrijas (FEV1) novērtēšana. DL vērtējumsCO būtu jāapsver. Exubera efektivitāte un drošība pacientiem ar sākotnējo FEV1 vai DLCO Paredzams, ka <70% nav noteikts, un Exubera lietošana šai populācijai nav ieteicama.
Plaušu funkcijas novērtēšana (piemēram, spirometrija) ir ieteicama pēc pirmajiem 6 terapijas mēnešiem un pēc tam katru gadu, pat ja nav plaušu simptomu. Pacientiem, kuriem FEV1 ir samazinājies par ¥ ‰ 20%, salīdzinot ar sākotnējo līmeni, jāatkārto plaušu funkcijas testi. Ja apstiprinās FEV1 samazināšanās par 20% salīdzinājumā ar sākotnējo līmeni, Exubera lietošana jāpārtrauc. Plaušu simptomu klātbūtne un mazāka plaušu funkcijas samazināšanās var būt nepieciešama biežāka plaušu funkcijas kontrole un Exubera lietošanas pārtraukšana.
Pamatā esošā plaušu slimība
Exubera lietošana pacientiem ar pamata plaušu slimībām, piemēram, astmu vai HOPS, nav ieteicama, jo Exubera efektivitāte un drošība šajā populācijā nav pierādīta.
Bronhu spazmas
Pacientiem, kuri lieto Exubera, reti ziņots par bronhu spazmām. Pacientiem, kuriem rodas šāda reakcija, jāpārtrauc Exubera lietošana un nekavējoties jākonsultējas ar ārstu. Exubera atkārtotai ievadīšanai ir nepieciešams rūpīgs riska novērtējums, un to vajadzētu veikt tikai stingrā medicīniskā uzraudzībā ar pieejamu atbilstošu klīnisko aprīkojumu.
Starpperiodu elpošanas sistēmas slimības
Exubera klīnisko pētījumu laikā ir ievadīts pacientiem ar starpcitu elpošanas ceļu slimībām (piemēram, bronhītu, augšējo elpceļu infekcijām, rinītu). Pacientiem, kuri cieš no šiem stāvokļiem, 3-4% uz laiku pārtrauca Exubera terapiju. Pacientiem, kas ārstēti ar Exubera, nebija novērots paaugstināts hipoglikēmijas vai pasliktinātas glikēmijas kontroles risks, salīdzinot ar pacientiem, kuri ārstēti ar zemādas insulīnu. Starpperiodu elpošanas ceļu slimības laikā var būt nepieciešama rūpīga glikozes koncentrācijas kontrole asinīs un devas pielāgošana.
Informācija pacientiem
Pacienti jāinstruē par pašpārvaldes procedūrām, ieskaitot glikozes līmeņa kontroli; pareiza Exubera inhalācijas tehnika; un hipoglikēmijas un hiperglikēmijas pārvaldība. Pacienti jāinformē, kā rīkoties īpašās situācijās, piemēram, periodiski apstākļi (slimība, stress vai emocionāli apstākļi) traucējumi), nepietiekama vai izlaista insulīna deva, netīša palielinātas insulīna devas ievadīšana, nepietiekama barības uzņemšana vai izlaistas maltītes.
Pacienti jāinformē, ka klīniskajos pētījumos Exubera terapija bija saistīta ar nelielu, neprogresējošu plaušu funkcijas samazināšanos salīdzinājumā ar salīdzinošo terapiju. Tā kā Exubera ietekmē plaušu funkciju, pirms ārstēšanas uzsākšanas ar Exubera ieteicams veikt plaušu funkcijas testus. Pēc terapijas uzsākšanas ieteicams veikt periodiskas plaušu funkcijas pārbaudes (skatīt PIESARDZĪBAS PASĀKUMI Elpošanas, plaušu funkcija).
Pacientiem jāinformē ārsts, ja viņiem ir bijusi plaušu slimība, jo Exubera lietošana nav ieteicama pacientiem ar pamata plaušu slimību (piemēram, astmu vai HOPS), un tas ir kontrindicēts pacientiem ar slikti kontrolētu plaušu slimība.
Sievietēm ar cukura diabētu jāiesaka informēt ārstu, ja viņas ir stāvoklī vai plāno grūtniecību.
tops
Mijiedarbība ar zālēm
Vairākas vielas ietekmē glikozes metabolismu, un tām var būt nepieciešama insulīna devas pielāgošana un īpaši rūpīga uzraudzība.
Šie ir to vielu piemēri, kas var mazināt insulīna glikozes līmeni asinīs pazeminošo iedarbību, kas var izraisīt hiperglikēmiju: kortikosteroīdi, danazols, diazoksīds, diurētiskie līdzekļi, simpatomimētiski līdzekļi (piemēram, epinefrīns, albuterols, terbutalīns), glikagons, izoniazīds, fenotiazīna atvasinājumi, somatropīns, vairogdziedzera hormoni, estrogēni, progestogēni (piemēram, perorālos kontracepcijas līdzekļos), proteāzes inhibitori un netipiski antipsihotiski medikamenti (piemēram, olanzapīns un klozapīns).
Šie ir to vielu piemēri, kuras var pastiprināt insulīna glikozes līmeni asinīs pazeminošo iedarbību un jutīgumu pret hipoglikēmiju: perorāls antidiabēta līdzekļi, AKE inhibitori, disopiramīds, fibrāti, fluoksetīns, MAO inhibitori, pentoksifilīns, propoksifēns, salicilāti un sulfonamīds antibiotikas.
Beta blokatori, klonidīns, litija sāļi un alkohols var vai nu pastiprināt, vai mazināt insulīna glikozes līmeni asinīs pazeminošo iedarbību. Pentamidīns var izraisīt hipoglikēmiju, kurai dažreiz var sekot hiperglikēmija.
Turklāt simpatolītisku zāļu, tādu kā beta blokatori, klonidīns, guanetidīns un rezerpīns, ietekmē hipoglikēmijas pazīmes un simptomi var samazināties vai vispār nebūt.
Bronhodilatatori un citi inhalējamie produkti var mainīt ieelpotā cilvēka insulīna uzsūkšanos (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Īpašās populācijas). Ieteicams konsekvents bronhodilatatoru dozēšanas grafiks, salīdzinot ar Exubera ievadīšanu, stingri jākontrolē glikozes koncentrācija asinīs un attiecīgi jāpielāgo deva.
Kanceroģenēze, mutaģenēze, auglības pasliktināšanās
Divu gadu kancerogenitātes pētījumi ar dzīvniekiem nav veikti. Insulīns nebija mutagēns Ames baktēriju reversās mutācijas testā, ja bija vai nebija metaboliskas aktivizācijas.
Žurkām Sprague-Dawley tika veikts 6 mēnešu atkārtotas devas toksicitātes pētījums ar insulīna inhalācijas pulveri devās līdz 5,8 mg / kg dienā (salīdzinot ar klīnisko Sākotnējā deva bija 0,15 mg / kg dienā, žurku augstā deva bija 39 reizes vai 8,3 reizes lielāka nekā klīniskā deva, pamatojoties uz mg / kg vai mg / m2 ķermeņa virsmas laukuma salīdzinājumu). Cynomolgus pērtiķiem tika veikts 6 mēnešu atkārtotas devas toksicitātes pētījums ar inhalējamo insulīnu devās līdz 0,64 mg / kg dienā. Salīdzinot ar klīnisko sākuma devu 0,15 mg / kg dienā, pērtiķiem augstā deva bija 4,3 reizes vai 1,4 reizes lielāka par klīnisko devu, pamatojoties vai nu uz mg / kg, vai mg / m2 ķermeņa virsmas laukuma. Tās bija maksimāli pieļaujamās devas, kuru pamatā bija hipoglikēmija.
Salīdzinot ar kontroles dzīvniekiem, nevienai sugai nebija ar ārstēšanu saistītas nelabvēlīgas ietekmes uz plaušu funkciju, elpceļu bruto vai mikroskopisko morfoloģiju vai bronhu limfmezgliem. Tāpat nevienai no sugām nebija ietekmes uz šūnu proliferācijas indeksiem plaušu alveolārajā vai bronhiolārajā apgabalā.
Tā kā rekombinētais cilvēka insulīns ir identisks endogētajam hormonam, reproduktīvās / auglības pētījumi dzīvniekiem netika veikti.
Grūtniecība
Teratogēna iedarbība
C grūtniecības kategorija
Dzīvnieku vairošanās pētījumi ar Exubera nav veikti. Nav arī zināms, vai Exubera var radīt kaitējumu auglim, ja to lieto grūtniecei, vai arī Exubera var ietekmēt reproduktīvās spējas. Exubera grūtniecei jāievada tikai tad, ja tas ir absolūti nepieciešams.
Barojošās mātes
Daudzas zāles, ieskaitot cilvēka insulīnu, izdalās mātes pienā. Šī iemesla dēļ, lietojot Exubera sievietēm, kas baro bērnu ar krūti, jāievēro piesardzība. Pacientiem ar cukura diabētu, kas zīdīšanas laikā, var būt nepieciešams mainīt Exubera devu, ēdienreizes plānu vai abus.
Lietošana bērniem
Exubera ilgstoša drošība un efektivitāte bērniem nav noteikta (skatīt KLĪNISKĀ FARMAKOLOĢIJA, Īpašās populācijas).
Geriatriska lietošana
Kontrolētos 2/3 fāzes klīniskajos pētījumos (n = 1975) Exubera tika nozīmēts 266 pacientiem vecumā no 65 gadiem un 30 pacientiem vecumā no 75 gadiem. Lielākajai daļai šo pacientu bija 2. tipa cukura diabēts. Izmaiņas HbA1C hipoglikēmijas pakāpe un vecums neatšķīrās.
tops
Nevēlamās reakcijas
Exubera drošība atsevišķi vai kombinācijā ar zemādas insulīnu vai perorāliem līdzekļiem ir bijusi novērtēts aptuveni 2500 pieaugušiem pacientiem ar 1. vai 2. tipa cukura diabētu, kuri tika pakļauti Exubera. Aptuveni 2000 pacientu tika pakļauti Exubera ilgāk nekā 6 mēnešus, un vairāk nekā 800 pacienti tika pakļauti ilgāk nekā 2 gadus.
Ne-elpceļu nelabvēlīgi notikumi
Neieelpojošas blakusparādības, par kurām ziņots â ‰ ¥ 1% no 1977. gadā pacientiem, kuri ārstēti ar Exubera, kontrolētos 2/3 fāzes klīniskajos pētījumos, neatkarīgi no cēloņsakarības, ietver šādus (bet ne tikai):
Metabolisms un uzturs: hipoglikēmija (sk BRĪDINĀJUMI un PIESARDZĪBAS PASĀKUMI)
Ķermenis kopumā: sāpes krūtīs
Gremošanas līdzeklis: sausa mute
Īpašās maņas: vidusauss iekaisums (1. tipa bērnu diabētiķi)
Hipoglikēmija
Hipoglikēmijas biežums un biežums bija salīdzināms starp Exubera un zemādas parasto cilvēka insulīnu pacientiem ar 1. un 2. tipa cukura diabētu. 2. Tipa pacientiem, kuri nebija pietiekami kontrolēti ar viena perorāla līdzekļa terapiju, pievieno Exubera bija saistīta ar lielāku hipoglikēmijas līmeni nekā otrās perorālās lietošanas pievienošana aģents.
Sāpes krūtīs
Tika ziņots par virkni dažādu krūškurvja simptomu kā blakusparādībām, un tie tika grupēti zem nespecifiskā termina sāpes krūtīs. Šīs parādības novēroja 4,7% pacientu, kas ārstēti ar Exubera, un 3,2% pacientu, kas tika salīdzināti. Lielākā daļa (> 90%) no šiem gadījumiem tika ziņoti kā viegli vai vidēji smagi. Divi pacienti Exubera un viens salīdzinošajā grupā pārtrauca ārstēšanu sāpju dēļ krūtīs. Visu cēloņsakarību blakusparādību, kas saistītas ar koronāro artēriju slimību, piemēram, stenokardijas vai miokarda infarkta, biežums bija līdzīgs Exubera (0,7% stenokardijas; 0,7% miokarda infarkts) un salīdzināšanas līdzeklis (1,3% stenokardija; 0,7% miokarda infarkta) ārstēšanas grupas.
Sausa mute
Mutes sausums tika novērots 2,4% pacientu, kas ārstēti ar Exubera, un 0,8% pacientu, kas tika salīdzināti. Gandrīz viss (> 98%) mutes sausums bija viegls vai mērens. Neviens pacients pārtrauca ārstēšanu mutes sausuma dēļ.
Ausu notikumi bērnu diabēta slimniekiem
Pediatrijas 1. tipa diabēta pacienti Exubera grupās biežāk novēroja nevēlamās blakusparādības, kas saistītas ar ausu, nekā 1. tipa bērnu diabētiķi ārstēšanas grupās, kuras saņēma tikai zemādas insulīnu. Šajos gadījumos bija vidusauss iekaisums (Exubera 6,5%; SC 3,4%), ausu sāpes (Exubera 3,9%; SC 1,4%) un ausu slimības (Exubera 1,3%; SC 0%).
Elpceļu nelabvēlīgi notikumi
6. tabulā parādīts ziņoto elpceļu nevēlamo notikumu biežums katrā ārstēšanas grupā kontrolētos 2. un 3. fāzes klīniskajos pētījumos - 1% no jebkuras ārstēšanas grupas neatkarīgi no cēloņsakarības.
6. tabula. Respiratorās blakusparādības, par kurām ziņots â ‰ ¥ 1% no jebkuras ārstēšanas grupas kontrolētos 2. un 3. fāzes klīniskajos pētījumos, neatkarīgi no cēloņsakarības
| To pacientu procentuālā daļa, kuri ziņo par notikumu | |||||
|---|---|---|---|---|---|
| Nelabvēlīgs notikums | 1. tipa diabēts | 2. tipa diabēts | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
OAs N = 644 |
|
| SC = zemādas insulīna salīdzinātājs; OA = perorālo līdzekļu salīdzinātāji | |||||
| Elpošanas ceļu infekcija | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Palielināts klepus | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| Faringīts | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| Rinīts | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| Sinusīts | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Elpošanas traucējumi | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| Aizdusa | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Palielināts krēpas | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| Bronhīts | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| Astma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| Epistaksa | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| Laringīts | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| Pneimonija | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Balss izmaiņas | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
Klepus
3 klīniskajos pētījumos pacienti, kuri aizpildīja anketas par klepu, ziņoja, ka klepus mēdz parādīties laikā sekundēs līdz minūtēs pēc Exubera ieelpošanas, pārsvarā bija vieglas pakāpes un reti bija produktīvs daba. Turpinot Exubera lietošanu, šī klepus biežums samazinājās. Kontrolētos klīniskajos pētījumos klepus dēļ 1,2% pacientu pārtrauca ārstēšanu ar Exubera.
Aizdusa
Gandrīz par visu (> 97%) aizdusu tika ziņots par vieglu vai mērenu. Neliels skaits ar Exubera ārstēto pacientu (0,4%) pārtrauca ārstēšanu aizdusa dēļ, salīdzinot ar 0,1% pacientu, kas ārstēti ar salīdzinājuma terapiju.
Citi elpceļu nelabvēlīgi notikumi - faringīts, palielināta krēpa un niezoši
Lielākā daļa no šiem gadījumiem tika ziņoti kā viegli vai vidēji smagi. Neliels skaits ar Exubera ārstēto pacientu pārtrauca ārstēšanu faringīta dēļ (0,2%) un palielinājās krēpas (0,1%); Neviens pacients pārtrauca ārstēšanu niezošas slimības dēļ.
Plaušu funkcija
Exubera ietekme uz elpošanas sistēmu tika novērtēta vairāk nekā 3800 pacientiem kontrolētos 2. un 3. fāzes klīniskajos pētījumos (kuros 1977 pacienti tika ārstēti ar Exubera). Randomizētos, atklātos klīniskajos pētījumos, kas ilga līdz diviem gadiem, pacientus ārstēja ar Exubera parādīja lielāku plaušu funkcijas samazināšanos, it īpaši piespiedu izelpas tilpumu vienā otrais (FEV1) un oglekļa monoksīda izkliedēšanas spēja (DLCO) nekā ar salīdzinošu terapiju ārstētiem pacientiem. Vidējās ārstēšanas grupas atšķirības FEV1 un DLCO, tika novērotas dažās pirmajās Exubera terapijas nedēļās, un divu gadu ārstēšanas periodā tās progresēja ne vairāk. Vienā pabeigtā kontrolētā klīniskā pētījumā pacientiem ar 2. tipa cukura diabētu pēc divu gadu ilgas ārstēšanas ar Exubera pacienti parādīja FEV atšķirību ārstēšanas grupā1 sešas nedēļas pēc terapijas pārtraukšanas. Exubera ietekmes uz plaušu darbību izšķirtspēja pacientiem ar 1. tipa cukura diabētu pēc ilgstošas ārstēšanas nav pētīta.
3. līdz 6. attēlā parādīts vidējais FEV1 un DLCO izmaiņas no sākotnējā stāvokļa salīdzinājumā ar laiku no diviem notiekošiem randomizētiem, atklātiem, divu gadu pētījumiem ar 580 pacientiem ar 1. tipa un 620 pacientiem ar 2. tipa cukura diabētu.
3. attēls: Pārmaiņas no sākotnējā FEV1 (L) līmeņa pacientiem ar 1. tipa cukura diabētu (vidējais rādītājs +/– standarta novirze)

4. attēls: Pārmaiņas no sākotnējā FEV1 (L) līmeņa pacientiem ar 2. tipa cukura diabētu (vidējais rādītājs +/– standarta novirze)

Pēc 2 gadu ārstēšanas ar Exubera pacientiem ar 1. un 2. tipa cukura diabētu atšķirība starp ārstēšanas grupām vidējās izmaiņas salīdzinājumā ar sākotnējo FEV1 bija aptuveni 40 ml, dodot priekšroku salīdzinātājs.
5. attēls: Pārmaiņas no sākotnējā DLco (ml / min / mmHg) pacientiem ar 1. tipa cukura diabētu (vidējā +/– standarta novirze)

6. attēls: Pārmaiņas no sākotnējā DLco (ml / min / mmHg) pacientiem ar 2. tipa cukura diabētu (vidējā +/– standarta novirze)
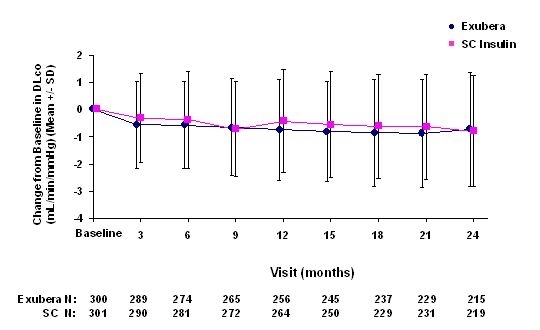
Pēc 2 gadu ārstēšanas ar Exubera atšķirības starp ārstēšanas grupām vidējām izmaiņām salīdzinājumā ar sākotnējo DLCO bija aptuveni 0,5 ml / min / mmHg (1. tipa diabēts), dodot priekšroku salīdzināmajam, un aptuveni 0,1 ml / min / mmHg (2. tipa diabēts), dodot priekšroku Exubera.
Divu gadu klīnisko pētījumu laikā atsevišķiem pacientiem novēroja ievērojamu plaušu funkcijas samazināšanos abās ārstēšanas grupās. Samazināšanās no sākotnējā FEV līmeņa1 no 20% no pēdējās novērošanas reizes bija 1,5% ar Exubera ārstēto un 1,3% ar salīdzinājumu ārstēto pacientu. Samazināšanās no sākotnējā DL līmeņaCO no 20% no pēdējās novērošanas reizes bija 5,1% ar Exubera ārstēto pacientu un 3,6% pacientu, kas ārstēti ar salīdzinošo terapiju.
tops
Pārdozēšana
Hipoglikēmija var rasties pārmērīga insulīna daudzuma dēļ, salīdzinot ar uzturu, enerģijas patēriņu vai abiem.
Vieglas vai vidēji smagas hipoglikēmijas epizodes parasti var ārstēt ar perorālu glikozi. Var būt nepieciešama zāļu devas, ēdienreizes vai fiziskās aktivitātes pielāgošana.
Smagas hipoglikēmijas epizodes ar komu, krampjiem vai neiroloģiskiem traucējumiem var ārstēt ar intramuskulāru / zemādas glikagonu vai koncentrētu intravenozu glikozi. Var būt nepieciešama ilgstoša ogļhidrātu uzņemšana un novērošana, jo pēc acīmredzamas klīniskas atveseļošanās hipoglikēmija var atkārtoties.
tops
Devas un ievadīšana
Exubera, tāpat kā ātras darbības insulīna analogiem, ir daudz straujāka glikozes līmeņa pazemināšanās aktivitāte, salīdzinot ar subkutāni ievadītu parasto cilvēka insulīnu. Exubera glikozes līmeni pazeminošās aktivitātes ilgums ir salīdzināms ar subkutāni ievadītu parasto cilvēka insulīnu un ilgāks par ātras darbības insulīnu. Exubera devas jāievada tieši pirms ēšanas (ne vairāk kā 10 minūtes pirms katras ēdienreizes).
Pacientiem ar 1. tipa cukura diabētu Exubera jālieto shēmās, kas ietver ilgstošākas darbības insulīnu. Pacientiem ar 2. tipa cukura diabētu Exubera var lietot monoterapijas veidā vai kombinācijā ar perorāliem līdzekļiem vai ilgstošākas darbības insulīnu.
Tā kā Exubera ietekmē plaušu darbību, visiem pacientiem pirms Exubera terapijas uzsākšanas jāveic plaušu funkcijas novērtēšana. Pacientiem, kuri tiek ārstēti ar Exubera, ieteicams periodiski kontrolēt plaušu funkciju (skatīt PIESARDZĪBAS PASĀKUMI, Plaušu funkcija).
Exubera ir paredzēts ievadīšanai ieelpojot, un to drīkst ievadīt tikai ar Exubera palīdzību® Ieelpo. Skatiet Exubera medikamentu ceļvedis Exubera aprakstam® Inhalators un instrukcijas par inhalatora lietošanu.
Sākotnējās eksubera devas pirms ēšanas aprēķināšana
Sākotnējā Exubera deva jā individualizē un jānosaka, pamatojoties uz ārsta ieteikumiem, atbilstoši pacienta vajadzībām. Ieteicamās sākotnējās devas pirms ēšanas ir balstītas uz klīniskajiem pētījumiem, kuros pacientiem tika lūgts ēst trīs ēdienreizes dienā. Sākotnējās devas pirms ēšanas var aprēķināt, izmantojot šādu formulu: [Ķermeņa svars (kg) X 0,05 mg / kg = deva pirms ēšanas (mg)], noapaļota uz leju līdz tuvākajam veselajam miligramu skaitam (piemēram, 3,7 mg, noapaļota līdz 3 mg).
Aptuvenās vadlīnijas sākotnējām Exubera devām pirms ēšanas, pamatojoties uz pacienta ķermeņa svaru, ir norādītas 7. tabulā:
7. tabula. Aptuvenās vadlīnijas sākotnējai eksubera devai pirms ēšanas (ņemot vērā pacienta ķermeņa svaru)
| Pacienta svars (kg) |
Pacienta svars (lb) |
Sākotnējā deva uz maltīti | 1 mg blisteru skaits vienā devā | 3 mg blisteru skaits vienā devā |
|---|---|---|---|---|
| No 30 līdz 39,9 kg | 66 - 87 mārciņas | 1 mg vienā ēdienreizē | 1 | - |
| No 40 līdz 59,9 kg | 88 - 132 mārciņas | 2 mg vienā ēdienreizē | 2 | - |
| No 60 līdz 79,9 kg | 133–176 mārciņas | 3 mg vienā ēdienreizē | - | 1 |
| No 80 līdz 99,9 kg | 177 - 220 mārciņas | 4 mg vienā ēdienreizē | 1 | 1 |
| No 100 līdz 119,9 kg | 221–264 mārciņas | 5 mg vienā ēdienreizē | 2 | 1 |
| No 120 līdz 139,9 kg | 265–308 mārciņas | 6 mg vienā ēdienreizē | - | 2 |
1 mg Exubera inhalējamā insulīna blistera ir aptuveni ekvivalents 3 SV subkutāni ievadīta regulārā cilvēka insulīna. Exubera inhalējamā insulīna 3 mg blistera plāksnīte ir aptuveni ekvivalenta 8 SV subkutāni ievadīta regulārā cilvēka insulīna. 8. tabulā sniegta regulārā subkutāna cilvēka insulīna aptuvenā SV deva Exubera inhalējamo insulīna devām no 1 mg līdz 6 mg.
8. tabula: Parastā cilvēka zemādas insulīna aptuvenā ekvivalento SV deva Exubera inhalējamo insulīna devām no 1 mg līdz 6 mg
| Deva (mg) | Aptuvenā regulārā insulīna SC deva SV | 1 mg Exubera blisteru skaits vienā devā | 3 mg Exubera blisteru skaits vienā devā |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Pacientiem jāapvieno 1 mg un 3 mg blisteri tā, lai katrā devā tiktu uzņemts vismazākais blisteru skaits (piemēram, 4 mg deva jāievada kā viena 1 mg blistera un viena 3 mg blistera). Trīs 1 mg vienas devas blistera secīga inhalācija rada ievērojami lielāku insulīna iedarbību nekā vienas 3 mg vienas devas blistera ieelpošana. Tāpēc trīs 1 mg devas nedrīkst aizstāt ar vienu 3 mg devu (skatīt 4.2 KLĪNISKĀ FARMAKOLOĢIJA, Farmakokinētika). Kad pacients tiek stabilizēts, ievērojot dozēšanas shēmu, kurā ir 3 mg blisteri, un 3 mg blisteri ja tas īslaicīgi nav pieejams, pacients uz laiku var aizstāt divus 1 mg blisterus ar vienu 3 mg blisterī. Rūpīgi jākontrolē glikozes līmenis asinīs.
Tāpat kā ar visiem insulīniem, papildus faktoriem, kas jāņem vērā, nosakot Exubera sākumdevu, ir, bet ne tikai pacienta pašreizējā glikēmijas kontrole, iepriekšējā reakcija uz insulīnu, diabēta ilgums, kā arī uzturs un fiziskās aktivitātes ieradumi.
Devas titrēšanas apsvērumi
Pēc Exubera terapijas sākšanas, tāpat kā citiem glikozes līmeni pazeminošiem līdzekļiem, var būt nepieciešama devas pielāgošana, pamatojoties uz pacienta vajadzība (piemēram, glikozes koncentrācija asinīs, ēdienreizes lielums un barības vielu sastāvs, diennakts laiks un nesenais vai paredzamais) vingrinājums). Katram pacientam jābūt titrētam atbilstoši optimālajai devai, pamatojoties uz glikozes līmeņa asinīs monitoringa rezultātiem.
Tāpat kā visiem insulīniem, Exubera darbības laiks dažādiem indivīdiem vai vienam un tam pašam indivīdam var atšķirties.
Exubera var lietot starplaiku elpošanas ceļu slimību laikā (piemēram, bronhīts, augšējo elpceļu infekcija, rinīts). Var būt nepieciešama rūpīga glikozes koncentrācijas kontrole asinīs un devas pielāgošana individuāli. Pirms Exubera ievadīšanas jāievada inhalējamās zāles (piemēram, bronhodilatatori).
tops
Kā piegādāts
Exubera (cilvēka insulīns [rDNS izcelsme]) Inhalācijas pulveris ir pieejams 1 mg un 3 mg vienas devas blisteros. Blisteri tiek izdalīti uz perforētām kartēm, kurās ir seši vienas devas blisteri (PVC / alumīnijs). Divas stiprās puses ir atšķirīgas ar krāsu apdruku un taustes zīmēm, kuras var atšķirt ar pieskārienu. 1 mg blisteri un attiecīgās perforētās kartes ir iespiestas ar zaļu tinti, un kartes ir marķētas ar vienu paceltu joslu. 3 mg blisteri un attiecīgās perforētās kartes ir iespiestas ar zilu tinti, un kartes ir marķētas ar trim paceltām joslām.
Piecas blistera kartes iesaiņotas caurspīdīgas plastmasas (PET) termiski veidotā paplātē. Katrā PET paplātē ir arī desikants un tas ir pārklāts ar caurspīdīgu plastmasas (PET) vāku. Piecu blistera karšu paplāte (30 vienības devas blisteri) ir noslēgta folijas lamināta maisiņā ar žāvējošu līdzekli.
Exubera (cilvēka insulīns [rDNS izcelsme]) Inhalācijas pulvera blisteri, Exubera® Inhalators un Exubera nomaiņa® Lai sāktu terapiju ar Exubera, ir nepieciešamas atbrīvošanas vienības, un tās ir iekļautas Exubera komplektā. Pilnībā samontēts Exubera® Inhalatoru veido inhalatora pamatne, kamera un Exubera® Atbrīvošanas vienība. Pilnībā samontēts inhalators tiek iesaiņots ar rezerves kameru un ir pieejams Exubera komplektā un kā atsevišķa vienība. Kamera ir pieejama arī kā atsevišķa sastāvdaļa.
Exubera® Atbrīvošanas vienības tiek atsevišķi iesaiņotas noslēgtā termiski veidotā paplātē. Viena eksubera® Izlaišanas bloks ir iekļauts katrā pilnībā samontētajā inhalatorā. Divas papildu atbrīvošanas vienības ir paredzētas Exubera komplektā un katrā kombinētajā iepakojumā. Exubera atbrīvošanas bloki ir pieejami arī atsevišķi.
Šo konfigurāciju aprakstu skatīt 9. un 10. tabulā.
9. tabula
| Exubera (cilvēka insulīna [rDNS izcelsme]) inhalācijas pulveris ir pieejams šādi: | ||
|---|---|---|
| Apraksts | Saturs | NDC |
| Exubera KIT | 1 Exubera inhalators 1 rezerves kamera 1 mg - 180 blisteri 3 mg - 90 blisteri 2 Exubera® Atbrīvojiet vienības |
0069-0050-85 |
| Exubera kombinācijas iepakojums 12 | 1 mg - 90 blisteri 3 mg - 90 blisteri 2 Exubera® Atbrīvojiet vienības |
0069-0050-19 |
| Exubera kombinētais iepakojums 15 | 1 mg - 180 blisteri 3 mg - 90 blisteri 2 Exubera® Atbrīvojiet vienības |
0069-0050-53 |
| Exubera 1 mg pacienta iepakojums | 90 - 1 mg 2 Exubera® Atbrīvojiet vienības |
0069-0707-37 |
| Exubera 3 mg pacienta iepakojums | 90 - 3 mg 2 Exubera® Atbrīvojiet vienības |
0069-0724-37 |
10. tabula
| Exubera® Inhalatori un komponenti ir pieejami šādi: | ||
|---|---|---|
| Apraksts | Saturs | NDC |
| Exubera® Inhalatori un kamera | 1 Exubera® Ieelpo 1 rezerves kamera |
0069-0054-19 |
| Exubera® Atbrīvojiet vienības | 2 Exubera® Atbrīvojiet vienības | 0069-0097-41 |
| Exubera® Palāta | 1 rezerves kamera | 0069-0061-19 |
Blistera uzglabāšana
Nelieto (neatvērts): Uzglabāt kontrolētā istabas temperatūrā, 25 ° C (77 ° F); ekskursijas atļautas līdz 15-30 ° C (59-86 ° F) [skatīt USP kontrolēto telpas temperatūru]. Nesasaldēt. Nesasaldēt.
Lietošana: Tiklīdz folijas apvalks ir atvērts, vienas devas blisteri ir jāsargā no mitruma un jāuzglabā 25 ° C (77 ° F); ekskursijas atļautas līdz 15-30 ° C (59-86 ° F) [skatīt USP kontrolēto telpas temperatūru]. Nesasaldēt. Nesasaldēt. Blisteri ar vienas devas lietošanu jāizlieto 3 mēnešu laikā pēc folijas apvalka atvēršanas. Lai pasargātu no mitruma, pūslīšus novietojiet atpakaļ apvalkā. Papildu piesardzība jāveic, lai izvairītos no mitras vides, piem. tvaikojoša vannas istaba pēc dušas.
Izmetiet blistera saturu, ja tas ir sasalis.
Inhalatoru uzglabāšana
Uzglabāt kontrolētā istabas temperatūrā, 25 ° C (77 ° F); ekskursijas atļautas līdz 15-30 ° C (59-86 ° F) [skatīt USP kontrolēto telpas temperatūru]. Nesasaldēt. Nesasaldēt.
Exubera® Inhalatoru var lietot ne ilgāk kā 1 gadu no pirmās lietošanas dienas.
Exubera aizstāšana® Atbrīvošanas vienība
Exubera® Atbrīvošanas vienība Exubera® Inhalators jāmaina ik pēc 2 nedēļām.
Sargāt no bērniem
Tikai Rx

LAB-0331-12.0
pēdējā pārskatīšana 04/2008
Exubera, cilvēka insulīns [rDNS izcelsme] Informācija par pacientu (vienkāršā angļu valodā)
Sīkāka informācija par diabēta pazīmēm, simptomiem, cēloņiem, ārstēšanu
Informācija šajā monogrāfijā nav paredzēta, lai aptvertu visus iespējamos lietojumus, norādījumus, piesardzības pasākumus, zāļu mijiedarbību vai nelabvēlīgo iedarbību. Šī informācija ir vispārināta un nav paredzēta kā īpaša medicīniska konsultācija. Ja jums ir jautājumi par lietotajām zālēm vai vēlaties uzzināt vairāk informācijas, sazinieties ar ārstu, farmaceitu vai medmāsu.
atpakaļ uz: Pārlūkot visus medikamentus diabēta ārstēšanai

