Onglyza diabēta ārstēšanai
Zīmols: Onglyza
Vispārīgais nosaukums: saksagliptīns
Devas forma: tablete, apvalkota
Saturs:
Indikācijas un lietošana
Devas un ievadīšana
Devas formas un stiprās puses
Kontrindikācijas
Brīdinājumi un piesardzība
Nevēlamās reakcijas
Mijiedarbība ar zālēm
Lietošana īpašās populācijās
Pārdozēšana
Apraksts
Farmakoloģija
Neklīniskā toksikoloģija
Klīniskie pētījumi
Kā piegādāts
Informācija par Onglyza pacientu (vienkāršā angļu valodā)
Indikācijas un lietošana
Monoterapija un kombinētā terapija
Onglyza ir indicēts kā diētas un fiziskās aktivitātes papildinājums, lai uzlabotu glikēmijas kontroli pieaugušajiem ar 2. tipa cukura diabētu. [Skatīt Klīniskie pētījumi].
Svarīgi lietošanas ierobežojumi
Onglyza nedrīkst lietot 1. tipa cukura diabēta vai diabētiskās ketoacidozes ārstēšanai, jo tas šajos apstākļos nebūtu efektīvs.
Onglyza nav pētīts kombinācijā ar insulīnu.
tops
Devas un ievadīšana
Ieteicamā dozēšana
Ieteicamā Onglyza deva ir 2,5 mg vai 5 mg vienu reizi dienā neatkarīgi no ēdienreizēm.
Pacienti ar nieru darbības traucējumiem
Pacientiem ar viegliem nieru darbības traucējumiem (kreatinīna klīrenss [CrCl]> 50 ml / min) nav ieteicams pielāgot Onglyza devu.
Onglyza deva ir 2,5 mg vienreiz dienā pacientiem ar vidēji smagiem vai smagiem nieru darbības traucējumiem vai ar nieru slimības beigu stadiju (ESRD), kurai nepieciešama hemodialīze (kreatinīna klīrenss [CrCl] â ¤ 50 ml / min). Onglyza jāievada pēc hemodialīzes. Onglyza nav pētīts pacientiem, kuriem tiek veikta peritoneālā dialīze.
Tā kā Onglyza deva jāierobežo līdz 2,5 mg, ņemot vērā nieru darbību, pirms Onglyza sākšanas un periodiski pēc tam ieteicams novērtēt nieru darbību. Nieru darbību var noteikt pēc kreatinīna līmeņa serumā, izmantojot Cockcroft-Gault formulu vai diētas modifikāciju nieru slimības formulā. [Skatīt Klīniskā farmakoloģija, Farmakokinētika.]
Spēcīgi CYP3A4 / 5 inhibitori
Onglyza deva ir 2,5 mg vienreiz dienā, ja to lieto vienlaikus ar spēcīgiem citohroma P450 3A4 / 5 (CYP3A4 / 5) inhibitoriem (piemēram, ketokonazols, atazanavīrs, klaritromicīns, indinavīrs, itrakonazols, nefazodons, nelfinavīrs, ritonavīrs, sakvinavīrs un telitromicīns). [Skatīt Mijiedarbība ar zālēm, CYP3A4 / 5 enzīmu un inhibitoru inhibitori Klīniskā farmakoloģija, Farmakokinētika.]
tops
Devas formas un stiprās puses
- Onglyza (saksagliptīns) 5 mg tabletes ir rozā, abpusēji izliektas, apaļas, apvalkotas tabletes ar "5" iespiestu vienā pusē un "4215" otrā pusē ar zilu tinti.
- Onglyza (saksagliptīns) 2,5 mg tabletes ir gaiši dzeltenas līdz gaiši dzeltenas, abpusēji izliektas, apaļas, apvalkotas tabletes ar iespiestu "2,5" vienā pusē un "4214" otrā pusē ar zilu tinti.
tops
Kontrindikācijas
Nav.
tops
Brīdinājumi un piesardzība
Lietošana kopā ar medikamentiem, kas izraisa hipoglikēmiju
Insulīna sekrēcijas līdzekļi, piemēram, sulfonilurīnvielas atvasinājumi, izraisa hipoglikēmiju. Tādēļ, lai samazinātu hipoglikēmijas risku, ja to lieto kombinācijā ar Onglyza, var būt nepieciešama mazāka insulīna sekrēcijas deva. [Skatīt Nevēlamās reakcijas, Klīnisko pētījumu pieredze.]
Makrovaskulāri iznākumi
Nav veikti klīniski pētījumi, kas pārliecinoši pierādītu makrovaskulāro risku mazināšanos, lietojot Onglyza vai citas antidiabēta zāles.
tops
Nevēlamās reakcijas
Klīnisko pētījumu pieredze
Tā kā klīniskie pētījumi tiek veikti ļoti dažādos apstākļos, blakusparādību biežums, kas novērots a Šīs zāles nevar tieši salīdzināt ar rādītājiem citas zāles klīniskajos pētījumos, un tās var neatspoguļot rādītājus, kas novēroti prakse.
Monoterapija un papildterapijas kombinētā terapija
Divos placebo kontrolētos monoterapijas pētījumos, kas ilga 24 nedēļas, pacienti tika ārstēti ar Onglyza 2,5 mg dienā, Onglyza 5 mg dienā un placebo. Tika veikti arī trīs 24 nedēļu, placebo kontrolēti, kombinētas terapijas papildpētījumi: viens ar metformīnu, viens ar tiazolidīndionu (pioglitazons vai rosiglitazons) un otrs ar glicerīdu. Šajos trīs pētījumos pacienti tika nejaušināti iedalīti papildterapijā ar Onglyza 2,5 mg dienā, Onglyza 5 mg dienā vai placebo. Vienā no monoterapijas pētījumiem un papildu kombinētajā pētījumā ar metformīnu tika iekļauta 10 mg saksagliptīna terapijas grupa.
Iepriekš definētā apkopotā divu nedēļu datu (neatkarīgi no glikēmiskās glābšanas) analīzē no diviem monoterapijas pētījumiem, papildinājuma metformīna izmēģinājumam, papildinājuma tiazolidīndiona (TZD) izmēģinājumam, un papildinājums glikurīda pētījumam, kopējais blakusparādību biežums pacientiem, kuri tika ārstēti ar Onglyza 2,5 mg un Onglyza 5 mg, bija līdzīgs kā placebo (72,0% un 72,2% pret 70,6%, attiecīgi). Terapijas pārtraukšana blakusparādību dēļ notika attiecīgi 2,2%, 3,3% un 1,8% pacientu, kuri attiecīgi saņēma Onglyza 2,5 mg, 5 mg Onglyza un placebo. Biežākās blakusparādības (ziņots vismaz 2 pacientiem, kuri ārstēti ar Onglyza 2,5 mg, vai vismaz 2 pacientiem, kuri ārstēti ar Onglyza 5 mg), kas saistīta ar priekšlaicīgu terapijas pārtraukšanu, ietvēra limfopēniju (attiecīgi 0,1% un 0,5% pret 0%), izsitumus (0,2% un 0,3% pret 0,3%), kreatinīna līmenis asinīs palielinājās (par 0,3% un 0% pret 0%), un kreatinīna fosfokināzes līmenis asinīs palielinājās (0,1% un 0,2%, salīdzinot ar 0%). Šīs apvienotās analīzes blakusparādības (neatkarīgi no pētnieka cēloņsakarības novērtējuma) ziņotas 2006. Gadā 5% pacientu, kuri ārstēti ar Onglyza 5 mg, un biežāk nekā pacientiem, kuri ārstēti ar placebo, 1. tabula.
1. tabula: Nevēlamās reakcijas (neatkarīgi no izmeklētāja cēloņsakarības novērtējuma) placebo kontrolētos pētījumos * Ziņots ~ 5% pacientu, kas ārstēti ar 5 mg un vairāk Onglyza, biežāk nekā pacientiem, kuri ārstēti ar Placebo
| Pacientu skaits (%) | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
Placebo N = 799 |
|
| * 5 placebo kontrolētos pētījumos ietilpst divi monoterapijas pētījumi un viens papildterapijas izmēģinājums ar katru no šiem: metformīnu, tiazolidīndionu vai glicerīdu. Tabulā parādīti 24 nedēļu dati neatkarīgi no glikēmiskās glābšanas. | ||
| Augšējo elpceļu infekcija | 68 (7.7) | 61 (7.6) |
| Urīnceļu infekcijas | 60 (6.8) | 49 (6.1) |
| Galvassāpes | 57 (6.5) | 47 (5.9) |
Pacientiem, kuri tika ārstēti ar Onglyza 2,5 mg, galvassāpes (6,5%) bija vienīgā blakusparādība, par kuru ziņots ar ātrumu a â 5% un biežāk nekā pacientiem, kuri tika ārstēti ar placebo.
Šajā apvienotajā analīzē blakusparādības, par kurām ziņots â ‰ 2% pacientu, kuri tika ārstēti ar Onglyza 2,5 mg vai Onglyza 5 mg, un â ‰ ¥ 1% biežāk nekā placebo, ietvēra: sinusīts (attiecīgi 2,9% un 2,6% pret 1,6%), sāpes vēderā (2,4% un 1,7% pret 0,5%), gastroenterīts (1,9% un 2,3% pret 0,9%) un vemšana (2,2% un 2,3% pret 1,3%) ).
Papildinājumā TZD pētījumā perifēras edēmas biežums bija lielāks Onglyza 5 mg, salīdzinot ar placebo (attiecīgi 8,1% un 4,3%). Onglyza 2,5 mg perifēras edēmas biežums bija 3,1%. Neviena no ziņotajām perifērās edēmas blakusparādībām neizraisīja pētījuma zāļu pārtraukšanu. Onglyza 2,5 mg un 5 mg Onglyza perifēriskās edēmas biežums salīdzinājumā ar placebo bija 3,6% un 2% pret 3%, lietojot monoterapijā, 2,1% un 2,1% salīdzinājumā ar 2,2%, kas tika pievienoti kā papildu terapija ar metformīnu, un 2,4% un 1,2% pret 2,2%, kas tika nozīmēti kā papildterapija glicurīds.
Lūzumu biežums bija attiecīgi 1,0 un 0,6 uz 100 pacienta gadiem Onglyza (apvienotā analīze - 2,5 mg, 5 mg un 10 mg) un placebo grupā. Lūzumu gadījumu biežums pacientiem, kuri saņēma Onglyza, laika gaitā nepalielinājās. Cēloņsakarība nav noskaidrota, un ne-klīniskajos pētījumos nav pierādīta saksagliptīna nelabvēlīgā ietekme uz kaulu.
Klīniskajā programmā tika novērots trombocitopēnijas gadījums, kas saskanēja ar idiopātiskas trombocitopēniskās purpura diagnozi. Šī notikuma saistība ar Onglyza nav zināma.
Nevēlamās blakusparādības, kas saistītas ar Onglyza un vienlaikus ar metformīnu, pacientiem, kas iepriekš nebija ārstēti ar 2. tipa cukura diabētu
2. tabulā parādītas ziņotās blakusparādības (neatkarīgi no pētnieka cēloņsakarības novērtējuma) 5% pacientu piedalīšanās papildu 24 nedēļu aktīvā kontrolētā pētījumā ar vienlaikus ievadītu Onglyza un metformīnu, iepriekš neārstējot pacientiem.
2. tabula: Sākotnējā terapija ar Onglyza un metformīna kombināciju pacientiem, kuri iepriekš nebija ārstējušies: ziņots par blakusparādībām (neatkarīgi no izmeklētāja novērtējuma) cēloņsakarību) 5% pacientu, kuri ārstēti ar kombinētu Onglyza 5 mg plus metformīna terapiju (un biežāk nekā pacientiem, kuri ārstēti ar metformīnu) Vienatnē)
| Pacientu skaits (%) | ||
|---|---|---|
| Onglyza 5 mg + metformīns * N = 320 |
Metformīns * N = 328 |
|
| * Metformīna lietošana tika sākta ar sākuma devu 500 mg dienā un tika titrēta līdz maksimāli 2000 mg dienā. | ||
| Galvassāpes | 24 (7.5) | 17 (5.2) |
| Nazofaringīts | 22 (6.9) | 13 (4.0) |
Hipoglikēmija
Hipoglikēmijas blakusparādības balstījās uz visiem ziņojumiem par hipoglikēmiju; vienlaikus glikozes mērīšana nebija nepieciešama. Papildu pētījumā par glikurīdu kopējais ziņotās hipoglikēmijas biežums bija lielāks Onglyza 2,5 mg un 5 mg Onglyza (13,3% un 14,6%) salīdzinājumā ar placebo (10,1%). Apstiprinātas hipoglikēmijas biežums šajā pētījumā, kas definēts kā hipoglikēmijas simptomi, ko pavada a pirksta kārbas glikozes vērtība â ‰ ¤ 50 mg / dL bija 2,4% un 0,8% Onglyza 2,5 mg un Onglyza 5 mg un 0,7% placebo. Ziņotās hipoglikēmijas biežums Onglyza 2,5 mg un 5 mg Onglyza salīdzinājumā ar placebo monoterapijas veidā bija 4,0% un 5,6%, salīdzinot ar Attiecīgi 4,1%, 7,8% un 5,8%, salīdzinot ar 5%, lietojot papildus terapiju ar metformīnu, un 4,1% un 2,7%, salīdzinot ar 3,8%, kas tika pievienoti kā papildterapija TZD. ZiĦotās hipoglikēmijas biežums bija 3,4% pacientu, kas iepriekš nebija ārstēti un kuri lietoja Onglyza 5 mg plus metformīnu, un 4,0% pacientu, kuri lietoja tikai metformīnu.
Paaugstinātas jutības reakcijas
Ar paaugstinātu jutību saistīti notikumi, piemēram, nātrene un sejas edēma, 5 pētījumu apvienotajā analīzē līdz 24. nedēļai tika ziņots par 1,5%, 1,5% un 0,4% pacientu, kuri saņēma Onglyza 2,5 mg, Onglyza 5 mg un placebo, attiecīgi. Nevienam no šiem gadījumiem pacientiem, kuri saņēma Onglyza, nebija nepieciešama hospitalizācija vai izmeklētāji ziņoja par dzīvībai bīstamu. Vienu ar saksagliptīnu ārstētu pacientu šajā apvienotajā analīzē pārtrauca ģeneralizētas nātrenes un sejas edēmas dēļ.
Vital Signs
Ar Onglyza ārstētiem pacientiem nav novērotas klīniski nozīmīgas dzīvībai svarīgo pazīmju izmaiņas.
Laboratorijas testi
Absolūtais limfocītu skaits
Lietojot Onglyza, novēroja no devas atkarīgu vidējo absolūto limfocītu skaita samazināšanos. Sākotnējā vidējā absolūtā limfocītu skaita ziņā aptuveni 2200 šūnas / mikrolitrā vidējais samazinājums ir aptuveni par 100 un 120 šūnām / mikrolitrs ar Onglyza attiecīgi 5 mg un 10 mg, salīdzinot ar placebo, tika novēroti 24. nedēļā piecu placebo kontrolētu klīnisko pētījumu apvienotā analīzē studijas. Līdzīga iedarbība tika novērota, lietojot Onglyza 5 mg sākotnējā kombinācijā ar metformīnu, salīdzinot ar tikai metformīnu. Onglyza 2,5 mg devā, salīdzinot ar placebo, netika novērota. Pacientu īpatsvars, kuriem tika ziņots par limfocītu skaitu 7 ¤ 750 šūnās / mikrolitrā, bija attiecīgi 0,5%, 1,5%, 1,4% un 0,4% saksagliptīna 2,5 mg, 5 mg, 10 mg un placebo grupās. Lielākajai daļai pacientu atkārtotas Onglyza iedarbības atkārtošanās netika novērota, lai gan dažiem pacientiem pēc atkārtotas terapijas atkārtošanās samazinājās, kā rezultātā Onglyza lietošana tika pārtraukta. Limfocītu skaita samazināšanās nebija saistīta ar klīniski nozīmīgām blakusparādībām.
Šī limfocītu skaita samazināšanās klīniskā nozīme attiecībā pret placebo nav zināma. Ja tas ir klīniski norādīts, piemēram, neparastas vai ilgstošas infekcijas gadījumā, jāmēra limfocītu skaits. Onglyza ietekme uz limfocītu skaitu pacientiem ar limfocītu patoloģijām (piemēram, cilvēka imūndeficīta vīruss) nav zināma.
Trombocīti
Sešos, dubultaklā, kontrolētā klīniskā drošuma un efektivitātes pētījumos Onglyza neuzrādīja klīniski nozīmīgu vai pastāvīgu ietekmi uz trombocītu skaitu.
tops
Mijiedarbība ar zālēm
CYP3A4 / 5 enzīmu induktori
Rifampīns nozīmīgi samazināja saksagliptīna iedarbību, nemainoties tā aktīvā metabolīta 5-hidroksisaksagliptīna laika koncentrācijas līknes (AUC) laukumam. Rifampīns neietekmēja plazmas dipeptidilpeptidāzes-4 (DPP4) aktivitātes kavēšanu 24 stundu devas intervālā. Tāpēc Onglyza devas pielāgošana nav ieteicama. [Skatīt Klīniskā farmakoloģija, Farmakokinētika.]
CYP3A4 / 5 enzīmu inhibitori
Mēreni CYP3A4 / 5 inhibitori
Diltiazems palielināja saksagliptīna iedarbību. Paredzams līdzīgs saksagliptīna koncentrācijas paaugstināšanās plazmā citas mērenas CYP3A4 / 5 klātbūtnes gadījumā. inhibitori (piemēram, amprenavīrs, aprepitants, eritromicīns, flukonazols, fosamprenavirs, greipfrūtu sula un verapamils); tomēr Onglyza devas pielāgošana nav ieteicama. [Skatīt Klīniskā farmakoloģija, Farmakokinētika.]
Spēcīgi CYP3A4 / 5 inhibitori
Ketokonazols ievērojami palielināja saksagliptīna iedarbību. Paredzams līdzīgs ievērojams saksagliptīna koncentrācijas palielināšanās plazmā ar citiem spēcīgiem CYP3A4 / 5 inhibitoriem. (piemēram, atazanavīrs, klaritromicīns, indinavīrs, itrakonazols, nefazodons, nelfinavīrs, ritonavīrs, sakvinavīrs un telitromicīns). Lietojot vienlaikus ar spēcīgu CYP3A4 / 5 inhibitoru, Onglyza deva jāierobežo līdz 2,5 mg. [Skatīt Devas un ievadīšana, Spēcīgi CYP3A4 / 5 inhibitori un Klīniskā farmakoloģija, Farmakokinētika.]
tops
Lietošana īpašās populācijās
Grūtniecība
Grūtniecības kategorija B
Nav piemērotu un labi kontrolētu pētījumu grūtniecēm. Tā kā pētījumi par dzīvnieku reprodukciju ne vienmēr paredz cilvēka reakciju, Onglyza, tāpat kā citas pretdiabēta zāles, grūtniecības laikā jālieto tikai tad, ja tas ir absolūti nepieciešams.
Saksagliptīns nebija teratogēns nevienā pārbaudītā devā, ja to ievadīja grūsnām žurkām un trušiem organoģenēzes periodos. Nepilnīga iegurņa pārkaulošanās, kas ir attīstības kavēšanās forma, žurkām notika ar devu 240 mg / kg jeb aptuveni 1503 un attiecīgi 66 reizes pārsniedz saksagliptīna un aktīvā metabolīta iedarbību uz cilvēkiem ar maksimālo ieteicamo devu (MRHD) 5 mg. Mātes toksicitāte un samazināts augļa ķermeņa svars tika novērots attiecīgi 7986 un 328 reizes pārsniedzot cilvēka ekspozīciju, lietojot saksagliptīnu un aktīvo metabolītu, izmantojot MRHD. Nelielas skeleta izmaiņas trušiem notika, lietojot mātei toksisku devu 200 mg / kg vai aptuveni 1432 un 992 reizes lielāku par MRHD. Lietojot žurkām kombinācijā ar metformīnu, saksagliptīns nebija teratogēns vai embrioletāls ekspozīcijas laikā, kas 21 reizes pārsniedza saksagliptīna MRHD. Metformīna kombinācija ar lielāku saksagliptīna devu (109 reizes lielāka par saksagliptīna MRHD) tika saistīta ar craniorachischisis (reti sastopams nervu caurules defekts, kam raksturīga nepilnīga galvaskausa un mugurkaula aizvēršana) divos augļos vientuļais aizsprosts. Metformīna iedarbība katrā kombinācijā bija 4 reizes lielāka nekā ekspozīcija cilvēkam - 2000 mg dienā.
Saksagliptīna lietošana žurku mātītēm no 6. grūtniecības līdz 20. laktācijas dienai samazināja vīriešu un vīriešu ķermeņa svaru sieviešu dzimuma pēcnācēji tikai mātītei toksiskās devās (saksagliptīna un tā aktīvā metabolīta ekspozīcija ≥ 1629 un 53 reizes) MRHD). Žurku pēcnācējiem, kuriem tika ievadīta saksagliptīns jebkurā devā, netika novērota funkcionālā vai uzvedības toksicitāte.
Pēc dozēšanas grūsnām žurkām saksagliptīns šķērso placentu auglim.
Barojošās mātes
Saksagliptīns izdalās žurku laktācijas laikā pienā apmēram 1: 1 attiecībā pret zāļu koncentrāciju plazmā. Nav zināms, vai saksagliptīns izdalās mātes pienā. Tā kā daudzas zāles izdalās mātes pienā, jāievēro piesardzība, ordinējot Onglyza sievietei, kas baro bērnu ar krūti.
Lietošana bērniem
Onglyza drošība un efektivitāte bērniem nav noteikta.
Geriatriska lietošana
Sešos, dubultaklos, kontrolētos klīniskos drošuma un efektivitātes pētījumos ar Onglyza 634 (15,3%) no 4148 randomizētajiem pacientiem bija 65 gadus veci un vecāki, un 59 (1,4%) pacienti bija 75 gadus veci un vecāki. Starp pacientiem vecumā no 65 gadiem un jaunākiem pacientiem netika novērotas vispārējas drošības vai efektivitātes atšķirības. Kaut arī šī klīniskā pieredze nav atklājusi atšķirības atbildes reakcijā starp gados vecākiem un jaunākiem pacientiem, nevar izslēgt dažu gados vecāku indivīdu lielāku jutīgumu.
Saksagliptīns un tā aktīvais metabolīts daļēji tiek izvadīts caur nierēm. Tā kā gados vecākiem pacientiem ir pavājināta nieru darbība, gados vecākiem cilvēkiem, izvēloties devu, jāievēro piesardzība, ņemot vērā nieru funkciju. [Skatīt Devas un ievadīšana, Pacientiem ar nieru darbības traucējumiem un Klīniskā farmakoloģija, Farmakokinētika.]
tops
Pārdozēšana
Kontrolētā klīniskā pētījumā vienreiz dienā, perorāli lietojot Onglyza veseliem cilvēkiem, devās līdz 400 mg dienā 2 nedēļas (80 reizes lielāks par MRHD) nebija ar devu saistītu klīnisku blakusparādību un klīniski nozīmīgas ietekmes uz QTc intervālu vai sirdi. likme.
Pārdozēšanas gadījumā jāuzsāk atbilstoša balstterapija, ko nosaka pacienta klīniskais stāvoklis. Saksagliptīns un tā aktīvais metabolīts tiek noņemts ar hemodialīzi (23% no devas 4 stundu laikā).
tops
Apraksts
Saksagliptīns ir perorāli aktīvs enzīma DPP4 inhibitors.
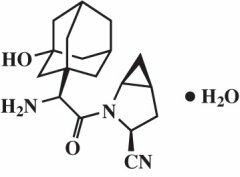
Saksagliptīna monohidrāts ķīmiski tiek aprakstīts kā (1S, 3S, 5S) -2 - [(2S) -2-amino-2- (3-hidrokstrictriciklo [3.3.1.13,7] dec-1-il) acetil] -2-azabiciklo [3.1.0] heksāns-3-karbonitrila, monohidrāta vai (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino-2 - (3-hidroksiadamantan-1-il) acetil] -2-azabiciklo [3.1.0] heksāns-3-karbonitrila hidrāts. Empīriskā formula ir C18H25N3O2-H2O un molekulmasa ir 333,43. Strukturālā formula ir:
Saksagliptīna monohidrāts ir balts vai gaiši dzeltens vai gaiši brūns, nehigioloģisks, kristālisks pulveris. Tas ir vāji šķīstošs ūdenī 24 ° C ± 3 ° C temperatūrā, nedaudz šķīst etilacetātā un šķīst metanolā, etanolā, izopropilspirtā, acetonitrilā, acetonā un polietilēnglikolā 400 (PEG 400).
Katra apvalkotā Onglyza tablete iekšķīgai lietošanai satur 2,79 mg saksagliptīna hidrohlorīda (bezūdens), kas ekvivalents 2,5 mg saksagliptīna vai 5,58 mg saksagliptīna. hidrohlorīds (bezūdens), kas ekvivalents 5 mg saksagliptīnam, un šādām neaktīvām sastāvdaļām: laktozes monohidrāts, mikrokristāliskā celuloze, kroskarmelozes nātrijs un magnija stearāts. Turklāt plēves pārklājums satur šādas neaktīvas sastāvdaļas: polivinilspirtu, polietilēnglikolu, titāna dioksīdu, talku un dzelzs oksīdus.
tops
Klīniskā farmakoloģija
Darbības mehānisms
Palielināta hormonu inkretīna, piemēram, glikagonam līdzīgā peptīda-1 (GLP-1) un atkarīga no glikozes, koncentrācija insulinotropiskais polipeptīds (GIP) tiek izlaists asinsritē no tievās zarnas, reaģējot uz ēdienreizes. Šie hormoni izraisa insulīna izdalīšanos no aizkuņģa dziedzera beta šūnām no glikozes atkarīgā veidā, bet dažu minūšu laikā tos inaktivē dipeptidilpeptidāzes-4 (DPP4). GLP-1 samazina arī glikagona sekrēciju no aizkuņģa dziedzera alfa šūnām, samazinot glikozes ražošanu aknās. Pacientiem ar 2. tipa cukura diabētu GLP-1 koncentrācija ir samazināta, bet tiek saglabāta insulīna reakcija uz GLP-1. Saksagliptīns ir konkurētspējīgs DPP4 inhibitors, kas palēnina hormonu inkretīna inaktivāciju, tādējādi palielinot to asinsriti koncentrācijas un samazinot glikozes koncentrāciju tukšā dūšā un pēc ēdienreizēm pacientiem ar 2. tipa cukura diabētu atkarībā no glikozes cukura diabēts.
Farmakodinamika
Onglyza lietošana pacientiem ar 2. tipa cukura diabētu 24 stundas kavē DPP4 enzīma aktivitāti. Pēc perorālas glikozes slodzes vai ēdienreizēm šī DPP4 nomākšana izraisīja aktīvās vielas cirkulācijas līmeņa palielināšanos 2–3 reizes. GLP-1 un GIP, samazināta glikagona koncentrācija un palielināta no glikozes atkarīgā insulīna sekrēcija no aizkuņģa dziedzera beta šūnām. Insulīna līmeņa paaugstināšanās un glikagona līmeņa pazemināšanās bija saistīta ar zemāku glikozes koncentrāciju tukšā dūšā un samazinātu glikozes novirzi pēc perorālas glikozes līmeņa vai ēdienreizes.
Sirds elektrofizioloģija
Randomizētā, dubultmaskētā, placebo kontrolētā, četrvirzienu krosoverā, aktīvā salīdzinošā pētījumā, lietojot moksifloxacin 40 veseliem cilvēkiem, Onglyza nebija saistīta ar klīniski nozīmīgu QTc intervāla vai sirdsdarbības ātruma pagarināšanos, lietojot dienas devas līdz 40 mg (8 reizes MRHD).
Farmakokinētika
Saksagliptīna un tā aktīvā metabolīta 5-hidroksisaksagliptīna farmakokinētika bija līdzīga veseliem cilvēkiem un pacientiem ar 2. tipa cukura diabētu. Cmaks Saksagliptīna un tā aktīvā metabolīta AUC vērtības un proporcionāli palielinājās no 2,5 līdz 400 mg devu diapazonā. Pēc veseliem cilvēkiem 5 mg vienreizējas perorālas saksagliptīna devas saksagliptīna un tā aktīvā metabolīta vidējās AUC vērtības plazmā bija attiecīgi 78 ng-h / ml un 214 ng-h / ml. Atbilstošā plazma Cmaks vērtības bija attiecīgi 24 ng / ml un 47 ng / ml. AUC un C vidējā mainība (CV%)maks gan saksagliptīns, gan tā aktīvais metabolīts bija mazāk nekā 25%.
Atkārtojot reizi dienā, lietojot jebkuru devu, netika novērota ievērojama saksagliptīna vai tā aktīvā metabolīta uzkrāšanās. Saksagliptīna un tā aktīvā metabolīta klīrenss 14 dienu laikā, lietojot saksagliptīnu devās no 2,5 līdz 400 mg, vienu dienu dienā netika novērots atkarībā no devas un laika.
Absorbcija
Vidējais laiks līdz maksimālajai koncentrācijai (Tmaks) pēc 5 mg vienreiz dienā lietošanas bija 2 stundas saksagliptīnam un 4 stundas tā aktīvajam metabolītam. Lietojot kopā ar ēdienu ar augstu tauku saturu, T līmenis palielinājāsmaks saksagliptīna koncentrācija aptuveni par 20 minūtēm, salīdzinot ar tukšā dūšā novēroto. Lietojot maltīti, saksagliptīna AUC palielinājās par 27%, salīdzinot ar badošanos. Onglyza var lietot neatkarīgi no ēdienreizēm.
Izplatīšana
Saksagliptīns un tā aktīvais metabolīts in vitro saistās ar olbaltumvielām cilvēka serumā. Tāpēc nav paredzams, ka izmaiņas olbaltumvielu daudzumā dažādos slimības gadījumos (piemēram, nieru vai aknu darbības traucējumos) mainīs saksagliptīna izkārtojumu.
Vielmaiņa
Saksagliptīna metabolismu galvenokārt mediē citohroms P450 3A4 / 5 (CYP3A4 / 5). Galvenais saksagliptīna metabolīts ir arī DPP4 inhibitors, kas ir puse no tikpat spēcīga kā saksagliptīns. Tādēļ spēcīgi CYP3A4 / 5 inhibitori un induktori mainīs saksagliptīna un tā aktīvā metabolīta farmakokinētiku. [Skatīt Mijiedarbība ar zālēm.]
Izdalīšanās
Saksagliptīns tiek izvadīts caur nierēm un aknām. Pēc vienreizējas 50 mg devas ievadīšanas 14C-saksagliptīns, 24%, 36% un 75% devas tika izdalīts ar urīnu attiecīgi saksagliptīna, tā aktīvā metabolīta un kopējā radioaktivitātes veidā. Saksagliptīna vidējais nieru klīrenss (~ 230 ml / min) bija lielāks nekā vidējais aprēķinātais glomerulārās filtrācijas ātrums (~ 120 ml / min), kas liecina par aktīvu izdalīšanos caur nierēm. Kopumā 22% no ievadītās radioaktivitātes tika izdalīti fekālijās, kas bija saksagliptīna devas daļa, kas izdalījās ar žulti un / vai neuzsūcas zāles no kuņģa-zarnu trakta. Pēc vienreizējas perorālas Onglyza 5 mg devas ievadīšanas veseliem cilvēkiem vidējais plazmas terminālais eliminācijas pusperiods (t1/2) saksagliptīns un tā aktīvais metabolīts bija attiecīgi 2,5 un 3,1 stundas.
Īpašās populācijas
Nieru darbības traucējumi
Tika veikts vienas devas, atklāts pētījums, lai novērtētu saksagliptīna (10 mg deva) farmakokinētiku subjekti ar dažādas pakāpes hroniskiem nieru darbības traucējumiem (N = 8 katrā grupā), salīdzinot ar cilvēkiem ar normālu nieru darbību funkcija. Pētījumā piedalījās pacienti ar nieru darbības traucējumiem, pamatojoties uz kreatinīna klīrensu, klasificējot kā vieglus (> 50 līdz â ¤ 80) ml / min), vidēji (no 30 līdz â ¤ 50 ml / min) un smagi (<30 ml / min), kā arī pacientiem ar nieru slimību beigu stadijā hemodialīze. Kreatinīna klīrenss tika noteikts no seruma kreatinīna līmeņa, pamatojoties uz Cockcroft-Gault formulu:
CrCl = [140 gadu vecums (gadi)] svars (kg) {× 0,85 sievietēm pacientēm}
[72 creat seruma kreatinīns (mg / dL)]
Nieru darbības traucējumu pakāpe C neietekmējamaks saksagliptīna vai tā aktīvā metabolīta. Personām ar viegliem nieru darbības traucējumiem saksagliptīna un tā aktīvā metabolīta AUC vērtības bija attiecīgi par 20% un 70% lielākas nekā AUC vērtības indivīdiem ar normālu nieru darbību. Tā kā šāda apjoma palielināšana netiek uzskatīta par klīniski nozīmīgu, devas pielāgošana pacientiem ar viegliem nieru darbības traucējumiem nav ieteicama. Personām ar vidēji smagiem vai smagiem nieru darbības traucējumiem saksagliptīna un tā aktīvā AUC vērtības metabolīts bija attiecīgi līdz 2,1 un 4,5 reizes lielāks nekā AUC vērtības cilvēkiem ar normālu nieru līmeni funkcija. Lai sasniegtu saksagliptīna un tā aktīvā metabolīta ekspozīciju plazmā līdzīgi kā pacientiem ar normālu nieru darbību, ieteicamā deva ir 2,5 mg vienreiz dienā pacientiem ar vidēji smagiem un smagiem nieru darbības traucējumiem, kā arī pacientiem ar nieru slimību beigu stadijā hemodialīze. Saksagliptīns tiek noņemts ar hemodialīzi.
Aknu darbības traucējumi
Personām ar aknu darbības traucējumiem (A, B un C klases Child-Pugh) vidējā Cmaks Pēc vienreizējas 10 mg saksagliptīna devas saksagliptīna AUC un attiecīgi AUC bija par 8% un 77% augstāki nekā veselīgi kontrolētās kontrolgrupās. Atbilstošais Cmaks Aktīvā metabolīta AUC un AUC bija attiecīgi par 59% un 33% zemāki, salīdzinot ar veseliem kontrolgrupas testiem. Šīs atšķirības netiek uzskatītas par klīniski nozīmīgām. Pacientiem ar aknu darbības traucējumiem devas pielāgošana nav ieteicama.
Ķermeņa masas indekss
Devas pielāgošana nav ieteicama, pamatojoties uz ķermeņa masas indeksu (ĶMI), kas netika identificēts kā nozīmīgs kovariē saksagliptīna vai tā aktīvā metabolīta šķietamo klīrensu populācijas farmakokinētikā analīze.
Dzimums
Devas pielāgošana, ņemot vērā dzimumu, nav ieteicama. Saksagliptīna farmakokinētikā vīriešiem un sievietēm netika novērotas atšķirības. Salīdzinot ar vīriešiem, sievietēm aktīvā metabolīta ekspozīcijas vērtības bija aptuveni par 25% lielākas nekā vīriešiem, taču maz ticams, ka šī atšķirība būs klīniski nozīmīga. Populācijas farmakokinētiskajā analīzē dzimums netika identificēts kā nozīmīgs saksagliptīna un tā aktīvā metabolīta šķietamais klīrenss.
Geriatric
Devas pielāgošana nav ieteicama, ņemot vērā tikai vecumu. Gados vecākiem cilvēkiem (65-80 gadi) C bija par 23% un 59% augstāksmaks Saksagliptīna attiecīgi AUC un ģeometriskās vidējās AUC vērtības nekā jauniem cilvēkiem (18–40 gadi). Atšķirības aktīvo metabolītu farmakokinētikā starp gados vecākiem un jauniem cilvēkiem parasti atspoguļoja atšķirības, kas novērotas saksagliptīna farmakokinētikā. Atšķirība starp saksagliptīna un aktīvā metabolīta farmakokinētiku jauniem un veciem cilvēkiem subjekti, iespējams, ir vairāku faktoru dēļ, tai skaitā nieru funkcijas un metabolisma spēju pasliktināšanās pieaugošs vecums. Populācijas farmakokinētiskajā analīzē vecums netika identificēts kā nozīmīgs saksagliptīna un tā aktīvā metabolīta šķietamais klīrenss.
Pediatrijā
Pētījumi, kas raksturo saksagliptīna farmakokinētiku bērniem, nav veikti.
Rase un etniskā piederība
Ņemot vērā rasi, devas pielāgošana nav ieteicama. Populācijas farmakokinētiskajā analīzē tika salīdzināta saksagliptīna un tā aktīvā farmakokinētika metabolīts 309 kaukāziešu indivīdiem ar 105 cilvēkiem, kas nav kaukāzieši (sastāv no sešām rasēm) grupas). Starp šīm divām populācijām netika konstatētas būtiskas atšķirības saksagliptīna un tā aktīvā metabolīta farmakokinētikā.
Narkotiku un zāļu mijiedarbība
Zāļu mijiedarbības in vitro novērtējums
Saksagliptīna metabolismu galvenokārt regulē CYP3A4 / 5.
In vitro pētījumos saksagliptīns un tā aktīvais metabolīts neinhibēja CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 vai 3A4, kā arī neinducēja CYP1A2, 2B6, 2C9 vai 3A4. Tādēļ nav sagaidāms, ka saksagliptīns mainīs vienlaikus lietoto zāļu, kas tiek metabolizēti ar šiem fermentiem, metabolismu. Saksagliptīns ir P-glikoproteīnu (P-gp) substrāts, bet nav nozīmīgs P-gp inhibitors vai induktors.
Saksagliptīns un tā aktīvais metabolīts in vitro saistās ar olbaltumvielām cilvēka serumā. Tādējādi saistīšanās ar olbaltumvielām būtiski neietekmē saksagliptīna vai citu zāļu farmakokinētiku.
In vivo zāļu mijiedarbības novērtējums
Saksagliptīna ietekme uz citām zālēm
Pētījumos ar veseliem cilvēkiem, kā aprakstīts zemāk, saksagliptīns nozīmīgi nemainīja metformīna, glicurīda, pioglitazona, digoksīna, simvastatīna, diltiazēma vai ketokonazola farmakokinētika.
Metformīns: Vienlaicīga saksagliptīna (100 mg) un metformīna (1000 mg), kas ir hOCT-2 substrāts, deva nemainīja metformīna farmakokinētiku veseliem cilvēkiem. Tādēļ Onglyza nav hOCT-2 starpniecības transporta inhibitors.
Glyburide: Vienlaicīga saksagliptīna (10 mg) un glicurīda (5 mg), kas ir CYP2C9 substrāts, deva palielināja Cmaks glicurīda par 16%; tomēr glicurīda AUC nemainījās. Tādēļ Onglyza nozīmīgi neinhibē CYP2C9 starpniecību metabolismu.
Pioglitazons: vienlaicīga saksagliptīna (10 mg) un pioglitazona (45 mg), kas ir CYP2C8 substrāts, vienreizējas lietošanas palielināšana Cmaks pioglitazona par 14%; tomēr pioglitazona AUC nemainījās.
Digoksīns: vienlaicīga saksagliptīna (10 mg) un digoksīna (0,25 mg), kas ir P-gp substrāts, deva vienreiz dienā, nemainīja digoksīna farmakokinētiku. Tāpēc Onglyza nav P-gp-starpniecības transporta inhibitors vai induktors.
Simvastatīns: vienlaicīga saksagliptīna (10 mg) un simvastatīna (40 mg), kas ir CYP3A4 / 5 substrāts, deva vienreiz dienā, nemainīja simvastatīna farmakokinētiku. Tādēļ Onglyza nav CYP3A4 / 5 starpniecības metabolisma inhibitors vai induktors.
Diltiazems: Vienlaicīga saksagliptīna (10 mg) un diltiazema (360 mg ilgstošas darbības formula līdzsvara stāvoklī) vienlaicīga lietošana, mērens CYP3A4 / 5 inhibitors, palielināja C līmeni plazmā.maks diltiazēma par 16%; tomēr diltiazema AUC nemainījās.
Ketokonazols: vienlaicīga saksagliptīna (100 mg) un ketokonazola (200 mg ik pēc 12 stundām) deva līdzsvara stāvoklis), spēcīgs CYP3A4 / 5 un P-gp inhibitors, samazināja ketokonazola Cmax un AUC plazmā par 16% un 13%, attiecīgi.
Citu narkotiku ietekme uz saksagliptīnu
Metformīns: Vienlaicīga saksagliptīna (100 mg) un metformīna (1000 mg), kas ir hOCT-2 substrāts, deva, samazināja Cmaks saksagliptīna par 21%; tomēr AUC nemainījās.
Glyburide: vienlaicīga saksagliptīna (10 mg) un glicurīda (5 mg), CYP2C9 substrāta, deva palielināja Cmaks saksagliptīna par 8%; tomēr saksagliptīna AUC nemainījās.
Pioglitazons: vienlaicīga saksagliptīna (10 mg) un pioglitazona devu lietošana vienreiz dienā (45 mg), CYP2C8 (galvenais) un CYP3A4 (mazsvarīgais) substrāts nemainīja zāļu farmakokinētiku. saksagliptīns.
Digoksīns: vienlaicīga saksagliptīna (10 mg) un digoksīna (0,25 mg), kas ir P-gp substrāts, deva vienreiz dienā, nemainīja saksagliptīna farmakokinētiku.
Simvastatīns: vienlaicīga saksagliptīna (10 mg) un simvastatīna (40 mg), CYP3A4 / 5 substrāta, devu lietošana vienreiz dienā palielināja Cmaks saksagliptīna par 21%; tomēr saksagliptīna AUC nemainījās.
Diltiazems: Lietojot vienreizēju saksagliptīna (10 mg) devu un diltiazemu (360 mg ilgstošas darbības sastāvs līdzsvara stāvoklī), kas ir mērens CYP3A4 / 5 inhibitors, paaugstināja Cmaks saksagliptīna par 63% un AUC 2,1 reizes. Tas bija saistīts ar atbilstošu C samazināšanosmaks un aktīvā metabolīta AUC attiecīgi par 44% un 36%.
Ketokonazols: vienlaicīga saksagliptīna (100 mg) un ketokonazola (200 mg ik pēc 12 stundām līdzsvara stāvoklī) deva, spēcīgs CYP3A4 / 5 un P-gp inhibitors, palielināja Cmaks saksagliptīnam par 62% un AUC 2,5 reizes. Tas bija saistīts ar atbilstošu C samazināšanosmaks un aktīvā metabolīta AUC attiecīgi par 95% un 91%.
Citā pētījumā vienlaicīga saksagliptīna (20 mg) un ketokonazola (200 mg ik pēc 12 stundām līdzsvara stāvoklī) deva palielināja Cmaks Saksagliptīna AUC un AUC attiecīgi 2,4 un 3,7 reizes. Tas bija saistīts ar atbilstošu C samazināšanosmaks un aktīvā metabolīta AUC attiecīgi par 96% un 90%.
Rifampīns: vienlaicīga saksagliptīna (5 mg) un rifampīna (600 mg QD līdzsvara stāvoklī) deva samazināja Cmaks Saksagliptīna AUC un AUC attiecīgi par 53% un 76%, attiecīgi palielinot Cmaks (39%), bet aktīvā metabolīta plazmas AUC nozīmīgas izmaiņas nav.
Omeprazols: vienlaicīga saksagliptīna (10 mg) un omeprazola (40 mg), CYP2C19, deva vienreiz dienā. (galvenais) un CYP3A4 substrāts, CYP2C19 inhibitors un MRP-3 induktors, nemainīja saksagliptīns.
Alumīnija hidroksīds + magnija hidroksīds + simetikons: vienlaicīga saksagliptīna (10 mg) devas un šķidrums, kas satur alumīnija hidroksīdu (2400 mg), magnija hidroksīdu (2400 mg) un simetikonu (240 mg), samazināja Cmaks saksagliptīna par 26%; tomēr saksagliptīna AUC nemainījās.
Famotidīns: Vienreizēja saksagliptīna (10 mg) devas ievadīšana 3 stundas pēc vienas famotidīna (40 mg) devas, kas ir hOCT-1, hOCT-2 un hOCT-3 inhibitors, paaugstināšanas Cmaks saksagliptīna par 14%; tomēr saksagliptīna AUC nemainījās.
tops
Neklīniskā toksikoloģija
Kanceroģenēze, mutaģenēze, auglības pasliktināšanās
Saksagliptīns augstākajās novērtētajās devās neizraisīja audzēju ne pelēm (50, 250 un 600 mg / kg), ne žurkām (25, 75, 150 un 300 mg / kg). Pelēm lielākās novērtētās devas bija ekvivalentas aptuveni 870 (tēviņiem) un 1165 (mātītēm) reizēm ar iedarbību uz cilvēku, lietojot MRHD 5 mg / dienā. Žurkām ekspozīcija bija aptuveni 355 (tēviņi) un 2217 (mātītes) reizes lielāka nekā MRHD.
Saksagliptīns nebija mutagēns vai klastogēns ar metabolisma aktivāciju vai bez tās, izmantojot in vitro Ames baktēriju testu, in vitro citoģenētikas testu primārajam cilvēkam limfocīti, in vivo perorālo mikrokodolu tests žurkām, in vivo perorālās DNS atjaunošanas pētījums žurkām un perorāls in vivo / in vitro citoģenētiskais pētījums žurku perifērajās asinīs limfocīti. In vitro Ames baktēriju testā aktīvais metabolīts nebija mutagēns.
Žurku auglības pētījumā vīrieši tika ārstēti ar perorālo devu 2 nedēļas pirms pārošanās, pārošanās laikā un līdz plānotajam pārtraukšana (kopā apmēram 4 nedēļas), un mātītes 2 nedēļas pirms pārošanās grūtniecības laikā ārstēja ar perorālo barības devu. 7. diena. Netika novērota kaitīga ietekme uz auglību, ja ekspozīcija bija aptuveni 603 (vīrieši) un 776 (sievietes) reizes lielāka par MRHD. Lielākas devas, kas izraisīja toksicitāti mātei, arī palielināja augļa rezorbciju (aptuveni 2069 un 6138 reizes lielāks par MRHD). Papildu ietekme uz graujošo riteņbraukšanu, auglību, ovulāciju un implantāciju tika novērota aptuveni 6138 reizes pārsniedzot MRHD.
Dzīvnieku toksikoloģija
Saksagliptīns izraisīja nelabvēlīgas ādas izmaiņas cynomolgus pērtiķu ekstremitātēs (kreveles un / vai astes, ciparu, sēklinieku un / vai deguna čūlas un / vai čūlas). Ādas bojājumi bija atgriezeniski, 20 reizes pārsniedzot MRHD, bet dažos gadījumos tie bija neatgriezeniski un nekrotizējoši, ja ekspozīcija bija augstāka. Nevēlamas ādas izmaiņas netika novērotas, ja ekspozīcija bija līdzīga (1 līdz 3 reizes) 5 mg MRHD. Saksagliptīna klīniskajos pētījumos cilvēkiem nav novērota klīniska korelācija ar ādas bojājumiem pērtiķiem.
tops
Klīniskie pētījumi
Onglyza tika pētīts kā monoterapija un kombinācijā ar metformīna, glicurīda un tiazolidīndiona (pioglitazona un rosiglitazona) terapiju. Onglyza nav pētīts kombinācijā ar insulīnu.
Kopumā 4148 pacienti ar 2. tipa cukura diabētu tika randomizēti sešos, dubultmaskētos, kontrolētos klīniskos pētījumos, kas tika veikti, lai novērtētu Onglyza drošību un glikēmisko efektivitāti. Kopumā šajos pētījumos 3021 pacients tika ārstēts ar Onglyza. Šajos pētījumos vidējais vecums bija 54 gadi, un 71% pacientu bija kaukāzieši, 16% bija aziāti, 4% bija melnādainie un 9% bija citas rases grupas. Papildu 423 pacienti, ieskaitot 315, kuri saņēma Onglyza, piedalījās placebo kontrolētā, devu diapazona pētījumā, kura ilgums bija no 6 līdz 12 nedēļām.
Šajos sešos dubultaklā pētījumos Onglyza tika novērtēts ar devām 2,5 mg un 5 mg vienreiz dienā. Trīs no šiem pētījumiem novērtēja arī saksagliptīna devu 10 mg dienā. 10 mg saksagliptīna dienas deva nenodrošināja lielāku efektivitāti nekā 5 mg dienas deva. Ārstēšana ar Onglyza visās devās radīja klīniski nozīmīgus un statistiski nozīmīgus hemoglobīna A1c (A1C) uzlabojumus, tukšā dūšā glikozes līmenis plazmā (FPG) un 2 stundas pēc barības glikozes (PPG) pēc standarta perorālā glikozes tolerances testa (OGTT), salīdzinot ar kontrole. A1C līmeņa pazemināšanās tika novērota visās apakšgrupās, ieskaitot dzimumu, vecumu, rasi un sākotnējo ĶMI.
Onglyza, salīdzinot ar placebo, nebija saistīta ar būtiskām ķermeņa svara vai tukšā dūšā seruma lipīdu līmeņa izmaiņām salīdzinājumā ar sākotnējo līmeni.
Monoterapija
Kopumā 766 pacienti ar 2. tipa cukura diabētu, kuru uzturu un fizisko aktivitāti nepietiekami kontrolē (A1C - no 7% līdz 10%) piedalījās divos 24 nedēļu, dubultaklos, placebo kontrolētos pētījumos, novērtējot Onglyza efektivitāti un drošību monoterapija.
Pirmajā pētījumā pēc 2 nedēļu ilga akla uztura, fiziskās aktivitātes un placebo ievadīšanas perioda 401 pacienti tika nejaušināti iedalīti līdz 2,5 mg, 5 mg vai 10 mg Onglyza vai placebo. Pacienti, kuri pētījuma laikā nesasniedza noteiktus glikēmijas mērķus, tika ārstēti ar glābšanas terapiju ar metformīnu, pievienojot placebo vai Onglyza. Efektivitāte tika novērtēta pēdējos mērījumos pirms glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. Onglyza devas titrēšana nebija atļauta.
Ārstēšana ar Onglyza 2,5 mg un 5 mg dienā nodrošināja nozīmīgus uzlabojumus A1C, FPG un PPG salīdzinājumā ar placebo (3. tabula). To pacientu procentuālā daļa, kuri pārtrauca glikēmijas kontroles trūkuma dēļ vai kuri tika izglābti, lai tiktos iepriekš glikēmiskie kritēriji bija 16% Onglyza 2,5 mg terapijas grupā, 20% Onglyza 5 mg terapijas grupā un 26% terapijas grupā placebo grupa.
3. tabula: Glikēmiskie parametri 24. nedēļā placebo kontrolētā Onglyza monoterapijas pētījumā pacientiem ar 2. tipa cukura diabētu *
| Efektivitātes parametrs | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
Placebo N = 95 |
|---|---|---|---|
| * Paredzēts ārstēt pacientus, izmantojot pēdējos novērojumus pētījumā vai pēdējos novērojumus pirms metformīna glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. | |||
| †Zemāko kvadrātu vidējais rādītājs, kas pielāgots bāzes vērtībai. | |||
| c p-vērtība <0,0001, salīdzinot ar placebo | |||
| § p-vērtība <0,05, salīdzinot ar placebo | |||
| ¶ Onglyza 2,5 mg devas nozīmīgums netika pārbaudīts 2 stundu PPG. | |||
| A1C hemoglobīna līmenis (%) | N = 100 | N = 103 | N = 92 |
| Sākumstāvoklis (vidējais) | 7.9 | 8.0 | 7.9 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −0.4 | −0.5 | +0.2 |
| Atšķirība no placebo (koriģētais vidējais†) | −0.6c | −0.6c | |
| 95% ticamības intervāls | (−0.9, −0.3) | (−0.9, −0.4) | |
| To pacientu skaits procentos, kuri sasnieguši A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | N = 101 | N = 105 | N = 92 |
| Sākumstāvoklis (vidējais) | 178 | 171 | 172 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −15 | −9 | +6 |
| Atšķirība no placebo (koriģētais vidējais†) | −21 § | −15 § | |
| 95% ticamības intervāls | (−31, −10) | (−25, −4) | |
| 2 stundu postprandiāla glikoze (mg / dL) | N = 78 | N = 84 | N = 71 |
| Sākumstāvoklis (vidējais) | 279 | 278 | 283 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −45 | −43 | −6 |
| Atšķirība no placebo (koriģētais vidējais†) | −39 ¶ | −37 § | |
| 95% ticamības intervāls | (−61, −16) | (−59, −15) |
Tika veikts otrais 24 nedēļu monoterapijas pētījums, lai novērtētu Onglyza dozēšanas shēmu klāstu. Iepriekš neārstēti pacienti ar nepietiekami kontrolētu diabētu (A1C - no 7% līdz 10%) - 2 nedēļu ilgā, vienreizēji aklajā diētā, fiziskās aktivitātes un placebo ievadīšanas periodā. Kopumā 365 pacienti tika nejaušināti iedalīti līdz 2,5 mg katru rītu, 5 mg katru rītu, 2,5 mg ar iespējamo titrēšanu līdz 5 mg katru rītu vai 5 mg katru vakaru Onglyza vai placebo. Pacienti, kuri pētījuma laikā nesasniedza noteiktus glikēmijas mērķus, tika ārstēti ar metformīna glābšanas terapiju, kas pievienota placebo vai Onglyza; nejaušinātu pacientu skaits katrā ārstēšanas grupā bija no 71 līdz 74.
Ārstēšana ar 5 mg Onglyza katru rītu vai 5 mg katru vakaru nodrošināja nozīmīgus uzlabojumus A1C salīdzinājumā ar placebo (vidējais placebo koriģētais samazinājums attiecīgi par 0,4% un 0,3%). Ārstēšana ar Onglyza 2,5 mg katru rītu arī nodrošināja ievērojamu A1C uzlabojumu salīdzinājumā ar placebo (vidējais ar placebo koriģētais samazinājums par 0,4%).
Kombinētā terapija
Papildināmā kombinētā terapija ar metformīnu
Šajā 24 nedēļu randomizētā, dubultmaskētā, placebo kontrolētā pētījumā piedalījās 743 pacienti ar 2. tipa cukura diabētu, lai novērtētu Onglyza efektivitāte un drošība kombinācijā ar metformīnu pacientiem ar nepietiekamu glikēmijas kontroli (A1C â ¥ 7% un â ¤ 10%), lietojot metformīnu vienatnē. Lai varētu reģistrēties, pacientiem vismaz 8 nedēļas bija jālieto stabila metformīna deva (1500-2550 mg dienā).
Pacienti, kuri atbilda atbilstības kritērijiem, tika iekļauti ievadē pēc neredzīgajiem, divu nedēļu, diētas un vingrinājumu placebo periods, kurā pacienti saņēma metformīnu pirmspēdējā devā līdz 2500 mg dienā visu ārstēšanas laiku studēt. Pēc ievadīšanas perioda pacienti, kas bija tiesīgi, tika randomizēti līdz 2,5 mg, 5 mg vai 10 mg Onglyza vai placebo papildus pašreizējai atklātā metformīna devai. Pacienti, kuri pētījuma laikā nespēja sasniegt noteiktus glikēmijas mērķus, tika ārstēti ar pioglitazona glābšanas terapiju, ko papildināja ar esošajām pētījuma zālēm. Onglyza un metformīna devas titrēšana nebija atļauta.
Onglyza 2,5 mg un 5 mg papildinājums meformīnam nodrošināja nozīmīgus uzlabojumus A1C, FPG un PPG salīdzinājumā ar placebo papildinājumu metformīnam (4. tabula). Vidējās A1C sākotnējā stāvokļa izmaiņas laika gaitā un parametrā parādītas 1. attēlā. To pacientu īpatsvars, kuri pārtrauca glikēmijas kontroles trūkuma dēļ vai kuri tika izglābti, lai izpildītu noteiktos glikēmijas kritērijus, bija 15% Onglyza 2,5 mg papildinājuma metformīna grupā, 13% Onglyza 5 mg papildinājuma metformīna grupā un 27% placebo papildinājumā metformīnam grupa.
4. tabula: Glikēmiskie parametri 24. nedēļā placebo kontrolētā Onglyza pētījumā kā papildterapijas kombinēta terapija ar metformīnu *
| Efektivitātes parametrs | Onglyza 2,5 mg + Metformīns N = 192 |
Onglyza 5 mg + Metformīns N = 191 |
Placebo + Metformīns N = 179 |
|---|---|---|---|
| * Paredzēta ārstējama populācija, izmantojot pēdējos pētījuma novērojumus vai pēdējos novērojumus pirms pioglitazona glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. | |||
| †Zemāko kvadrātu vidējais rādītājs, kas pielāgots bāzes vērtībai. | |||
| c p-vērtība <0,0001, salīdzinot ar placebo + metformīnu | |||
| § p-vērtība <0,05, salīdzinot ar placebo + metformīnu | |||
| A1C hemoglobīna līmenis (%) | N = 186 | N = 186 | N = 175 |
| Sākumstāvoklis (vidējais) | 8.1 | 8.1 | 8.1 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −0.6 | −0.7 | +0.1 |
| Atšķirība no placebo (koriģētais vidējais†) | −0.7c | −0.8c | |
| 95% ticamības intervāls | (−0.9, −0.5) | (−1.0, −0.6) | |
| To pacientu skaits procentos, kuri sasnieguši A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | N = 188 | N = 187 | N = 176 |
| Sākumstāvoklis (vidējais) | 174 | 179 | 175 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −14 | −22 | +1 |
| Atšķirība no placebo (koriģētais vidējais†) | −16 § | −23 § | |
| 95% ticamības intervāls | (−23, −9) | (−30, −16) | |
| 2 stundu postprandiāla glikoze (mg / dL) | N = 155 | N = 155 | N = 135 |
| Sākumstāvoklis (vidējais) | 294 | 296 | 295 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −62 | −58 | −18 |
| Atšķirība no placebo (koriģētais vidējais†) | −44 § | −40 § | |
| 95% ticamības intervāls | (−60, −27) | (−56, −24) |
1. attēls: vidējās izmaiņas sākotnējā A1C līmenī placebo kontrolētā Onglyza pētījumā kā papildterapijas kombinācija ar metformīnu *

* Ietver pacientus ar sākotnējo stāvokli un 24. nedēļas vērtību.
24. nedēļā (LOCF) ir iekļauta ārstēšana ar nodomu ārstēt pacientus, izmantojot pēdējos pētījuma novērojumus pirms pioglitazona glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. Vidējās izmaiņas salīdzinājumā ar sākotnējo līmeni tiek koriģētas atbilstoši sākotnējai vērtībai.
Papildinoša kombinēta terapija ar tiazolidīndionu
Kopumā šajā 24 nedēļu randomizētā, dubultaklā, placebo kontrolētā pētījumā piedalījās 565 2. tipa diabēta pacienti, lai novērtētu Onglyza efektivitāte un drošība kombinācijā ar tiazolidīndionu (TZD) pacientiem ar nepietiekamu glikēmijas kontroli (A1C - no 7% līdz 10,5%) TZD vien. Lai varētu reģistrēties, pacientiem bija jālieto stabila pioglitazona deva (30-45 mg vienu reizi dienā). vai rosiglitazons (4 mg vienu reizi dienā vai 8 mg vai nu vienu reizi dienā vai divās dalītās 4 mg devās) vismaz 12 nedēļas.
Pacienti, kas atbilda atbilstības kritērijiem, tika iekļauti vienas aklā, divu nedēļu diētā un fiziskās aktivitātes placebo ievadīšanas periods, kura laikā pacienti TZD saņēma pirmspēdējā devā visu ārstēšanas laiku studēt. Pēc ievadīšanas perioda pacienti, kas bija tiesīgi, tika randomizēti līdz 2,5 mg vai 5 mg Onglyza vai placebo papildus viņu pašreizējai TZD devai. Pacienti, kuri pētījuma laikā nespēja sasniegt noteiktus glikēmijas mērķus, tika ārstēti ar metformīna glābšanu, ko papildināja ar esošajiem pētījuma medikamentiem. Pētījuma laikā Onglyza vai TZD devas titrēšana nebija atļauta. TZD režīma maiņa no rosiglitazona uz pioglitazonu noteiktās, līdzvērtīgās terapeitiskās devās tika atļauta pēc pētnieka ieskatiem, ja uzskatīja, ka tā ir medicīniski piemērota.
Onglyza 2,5 mg un 5 mg papildinājums TZD nodrošināja ievērojamus uzlabojumus A1C, FPG un PPG salīdzinājumā ar placebo papildinājumu TZD (5. tabula). To pacientu daļa, kuri pārtrauca darbību glikēmijas kontroles trūkuma dēļ vai kuri tika izglābti, lai izpildītu noteiktos glikēmijas kritērijus bija 10% Onglyza 2,5 mg papildinājuma TZD grupā, 6% Onglyza 5 mg papildinājuma TZD grupā un 10% placebo papildinājumā TZD grupā grupa.
5. tabula: Glikēmiskie parametri 24. nedēļā placebo kontrolētā Onglyza pētījumā kā papildterapijas kombinēta terapija ar tiazolidīndionu *
| Efektivitātes parametrs | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
Placebo + TZD N = 184 |
|---|---|---|---|
| * Paredzēts ārstēt pacientus, izmantojot pēdējos novērojumus pētījumā vai pēdējos novērojumus pirms metformīna glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. | |||
| †Zemāko kvadrātu vidējais rādītājs, kas pielāgots bāzes vērtībai. | |||
| c p-vērtība <0,0001, salīdzinot ar placebo + TZD | |||
| § p-vērtība <0,05, salīdzinot ar placebo + TZD | |||
| A1C hemoglobīna līmenis (%) | N = 192 | N = 183 | N = 180 |
| Sākumstāvoklis (vidējais) | 8.3 | 8.4 | 8.2 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −0.7 | −0.9 | −0.3 |
| Atšķirība no placebo (koriģētais vidējais†) | −0.4 § | −0.6c | |
| 95% ticamības intervāls | (−0.6, −0.2) | (−0.8, −0.4) | |
| To pacientu skaits procentos, kuri sasnieguši A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | N = 193 | N = 185 | N = 181 |
| Sākumstāvoklis (vidējais) | 163 | 160 | 162 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −14 | −17 | −3 |
| Atšķirība no placebo (koriģētais vidējais†) | −12 § | −15 § | |
| 95% ticamības intervāls | (−20, −3) | (−23, −6) | |
| 2 stundu postprandiāla glikoze (mg / dL) | N = 156 | N = 134 | N = 127 |
| Sākumstāvoklis (vidējais) | 296 | 303 | 291 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −55 | −65 | −15 |
| Atšķirība no placebo (koriģētais vidējais†) | −40 § | −50 § | |
| 95% ticamības intervāls | (−56, −24) | (−66, −34) |
Papildināmā kombinētā terapija ar Glyburide
Kopumā šajā 24 nedēļu, randomizētā, dubultmaskētā, placebo kontrolētā pētījumā piedalījās 768 pacienti ar 2. tipa cukura diabētu, lai novērtētu efektivitāti un drošību Onglyza kombinācijā ar sulfonilurīnvielu (SU) pacientiem ar nepietiekamu glikēmijas kontroli uzņemšanas brīdī (A1C ¥ ¥ 7,5% līdz ¤ ¤ 10%), lietojot submaksimālu SU devu vienatnē. Lai varētu reģistrēties, pacientiem 2 mēnešus vai ilgāk bija jālieto submaximal SU deva. Šajā pētījumā Onglyza kombinācijā ar fiksētu, vidēju SU devu tika salīdzināts ar titrēšanu līdz lielākai SU devai.
Pacienti, kas atbilda atbilstības kritērijiem, tika iekļauti viena aklā, četru nedēļu, diētas un fiziskās aktivitātes ievadperiodā, un viņus ieņēma 7,5 mg glicerīda vienu reizi dienā. Pēc ievadperioda pacienti, kuriem bija A1C â ¥ â 7% līdz ¤ ¤ 10%, tika randomizēti vai nu 2,5 mg vai 5 mg Onglyza papildinājuma 7,5 mg glicerīda vai placebo, kā arī 10 mg kopējās dienas devas glicurīds. Pacienti, kuri saņēma placebo, varēja paaugstināt glicurīda titru līdz kopējai dienas devai 15 mg. Pacientiem, kuri lietoja Onglyza 2,5 mg vai 5 mg, nebija atļauts paaugstināt glicurīda titrēšanu. Glikurīdu var samazināt par titru jebkurā ārstēšanas grupā vienu reizi 24 nedēļu ilgā pētījuma laikā hipoglikēmijas dēļ, ko pētnieks uzskata par nepieciešamu. Apmēram 92% pacientu placebo un glicurīda grupā tika palielināti līdz titrēšanai līdz galīgai kopējai dienas devai 15 mg pētījuma perioda pirmajās 4 nedēļās. Pacienti, kuri pētījuma laikā nespēja sasniegt noteiktus glikēmijas mērķus, tika ārstēti ar metformīna glābšanu, ko papildināja ar esošajiem pētījuma medikamentiem. Pētījuma laikā Onglyza devas titrēšana nebija atļauta.
Kombinācijā ar glicerīdu, Onglyza 2,5 mg un 5 mg deva nozīmīgus uzlabojumus A1C, FPG un PPG, salīdzinot ar placebo plus augšupielitētā glicurīda grupā (6. tabula). 18% pacientu, kuri pārtrauca darbību glikēmijas kontroles trūkuma dēļ vai kuri tika izglābti, lai izpildītu noteiktos glikēmijas kritērijus Onglyza 2,5 mg papildinājums gliburīda grupai, 17% Onglyza 5 mg papildinājuma glicurīda grupai un 30% placebo, kā arī papildināts titrēts glicerīds grupa.
6. tabula: Glikēmiskie parametri 24. nedēļā placebo kontrolētā Onglyza pētījumā kā papildinoša kombinēta terapija ar Glyburide *
| Efektivitātes parametrs | Onglyza 2,5 mg + Glyburide 7,5 mg N = 248 |
Onglyza 5 mg + Glyburide 7,5 mg N = 253 |
Placebo + Augstāk titrēts gliburīds N = 267 |
|---|---|---|---|
| * Paredzēts ārstēt pacientus, izmantojot pēdējos novērojumus pētījumā vai pēdējos novērojumus pirms metformīna glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. | |||
| †Zemāko kvadrātu vidējais rādītājs, kas pielāgots bāzes vērtībai. | |||
| c p-vērtība <0,0001, salīdzinot ar placebo + titrētu glicerīdu | |||
| § p-vērtība <0,05, salīdzinot ar placebo + titrētu glicerīdu | |||
| A1C hemoglobīna līmenis (%) | N = 246 | N = 250 | N = 264 |
| Sākumstāvoklis (vidējais) | 8.4 | 8.5 | 8.4 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −0.5 | −0.6 | +0.1 |
| Atšķirība no augšējā titrētā glicurīda (koriģētais vidējais†) | −0.6c | −0.7c | |
| 95% ticamības intervāls | (−0.8, −0.5) | (−0.9, −0.6) | |
| To pacientu skaits procentos, kuri sasnieguši A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | N = 247 | N = 252 | N = 265 |
| Sākumstāvoklis (vidējais) | 170 | 175 | 174 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −7 | −10 | +1 |
| Atšķirība no augšējā titrētā glicurīda (koriģētais vidējais†) | −8 § | −10 § | |
| 95% ticamības intervāls | (−14, −1) | (−17, −4) | |
| 2 stundu postprandiāla glikoze (mg / dL) | N = 195 | N = 202 | N = 206 |
| Sākumstāvoklis (vidējais) | 309 | 315 | 323 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −31 | −34 | +8 |
| Atšķirība no augšējā titrētā glicurīda (koriģētais vidējais†) | −38 § | −42 § | |
| 95% ticamības intervāls | (−50, −27) | (−53, −31) |
Vienlaicīga lietošana ar metformīnu pacientiem, kuri iepriekš nebija ārstējuši
Šajā 24 nedēļu randomizētā, dubultmaskētā, placebo kontrolētā pētījumā piedalījās 1306 pacienti, kas iepriekš nebija ārstēti ar 2. tipa cukura diabētu. novērtēt Onglyza un metformīna vienlaicīgas lietošanas efektivitāti un drošību pacientiem ar nepietiekamu glikēmijas kontroli (A1C no 8% līdz 12%) diētas un fiziskās aktivitātes laikā vienatnē. Lai iekļautos šajā pētījumā, pacientiem bija nepieciešama iepriekšēja ārstēšana.
Pacienti, kuri atbilda atbilstības kritērijiem, tika iekļauti viena aklā, vienas nedēļas, diētas un vingrinājumu placebo ievadperiodā. Pacienti tika nejaušināti iedalīti vienā no četrām ārstēšanas grupām: Onglyza 5 mg + 500 mg metformīna, 10 mg saksagliptīna + 500 mg metformīna, 10 mg saksagliptīns + placebo vai 500 mg metformīna + placebo. Onglyza deva vienu reizi dienā. 3 ārstēšanas grupās, kuras lietoja metformīnu, metformīna deva katru nedēļu tika palielināta ar titru 500 mg dienā, kā to panes, līdz maksimāli 2000 mg dienā, pamatojoties uz FPG. Pacienti, kuri pētījumu laikā nesasniedza noteiktus glikēmijas mērķus, tika ārstēti ar pioglitazona glābšanu kā papildterapiju.
Onglyza 5 mg un metformīna vienlaicīga lietošana nodrošināja nozīmīgus uzlabojumus A1C, FPG un PPG, salīdzinot ar placebo un metformīnu (7. tabula).
7. tabula: Glikēmiskie parametri 24. nedēļā placebo kontrolētā Onglyza vienlaicīgas lietošanas pētījumā ar metformīnu pacientiem, kuri iepriekš nebija ārstējuši
| Efektivitātes parametrs | Onglyza 5 mg + Metformīns N = 320 |
Placebo + Metformīns N = 328 |
|---|---|---|
| * Paredzēta ārstējama populācija, izmantojot pēdējos pētījuma novērojumus vai pēdējos novērojumus pirms pioglitazona glābšanas terapijas pacientiem, kuriem nepieciešama glābšana. | ||
| †Zemāko kvadrātu vidējais rādītājs, kas pielāgots bāzes vērtībai. | ||
| c p-vērtība <0,0001, salīdzinot ar placebo + metformīnu | ||
| § p-vērtība <0,05, salīdzinot ar placebo + metformīnu | ||
| A1C hemoglobīna līmenis (%) | N = 306 | N = 313 |
| Sākumstāvoklis (vidējais) | 9.4 | 9.4 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −2.5 | −2.0 |
| Atšķirība no placebo + metformīna (koriģētais vidējais†) | −0.5c | |
| 95% ticamības intervāls | (−0.7, −0.4) | |
| To pacientu skaits procentos, kuri sasnieguši A1C <7% | 60% §(185/307) | 41% (129/314) |
| Glikozes līmenis tukšā dūšā plazmā (mg / dL) | N = 315 | N = 320 |
| Sākumstāvoklis (vidējais) | 199 | 199 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −60 | −47 |
| Atšķirība no placebo + metformīna (koriģētais vidējais†) | −13 § | |
| 95% ticamības intervāls | (−19, −6) | |
| 2 stundu postprandiāla glikoze (mg / dL) | N = 146 | N = 141 |
| Sākumstāvoklis (vidējais) | 340 | 355 |
| Pārmaiņas salīdzinājumā ar sākotnējo līmeni (koriģētais vidējais†) | −138 | −97 |
| Atšķirība no placebo + metformīna (koriģētais vidējais†) | −41 § | |
| 95% ticamības intervāls | (−57, −25) |
tops
Kā piegādāts
Onglyza ™ (saksagliptīna) tabletēm ir marķējums abās pusēs, un tās ir pieejamas stiprumos un iepakojumos, kas uzskaitīti 8. tabulā.
| Tablete Spēks |
Apvalkotā tablete Krāsa / forma |
Tablete Marķējumi |
Iepakojuma lielums | NDC kods |
|---|---|---|---|---|
| 5 mg | rozā abpusēji izliekts, apaļš |
"5" vienā pusē un "4215" otrā pusē, ar zilu tinti | Pudeles pa 30 Pudeles no 90 Pudeles pa 500 Blistera 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | bāli dzeltens līdz gaiši dzeltens abpusēji izliekts, apaļš |
"2,5" vienā pusē un "4214" otrā pusē, ar zilu tinti | Pudeles pa 30 Pudeles no 90 |
0003-4214-11 0003-4214-21 |
Uzglabāšana un apstrāde
Uzglabāt 20 ° -25 ° C (68 ° -77 ° F); atļautas ekskursijas līdz 15 ° -30 ° C (59 ° -86 ° F) [skatīt USP kontrolēto istabas temperatūru].
tops
Pēdējoreiz atjaunināts: 07/09
E. R. Squibb & Sons, L.L.C.
Informācija par Onglyza pacientu
Sīkāka informācija par diabēta pazīmēm, simptomiem, cēloņiem, ārstēšanu
Informācija šajā monogrāfijā nav paredzēta visiem iespējamiem lietojumiem, norādījumiem, piesardzības pasākumiem, zāļu mijiedarbību vai nelabvēlīgu iedarbību. Šī informācija ir vispārināta un nav paredzēta kā īpaša medicīniska konsultācija. Ja jums ir jautājumi par lietotajām zālēm vai vēlaties uzzināt vairāk informācijas, sazinieties ar ārstu, farmaceitu vai medmāsu.
atpakaļ uz: Pārlūkot visus medikamentus diabēta ārstēšanai



